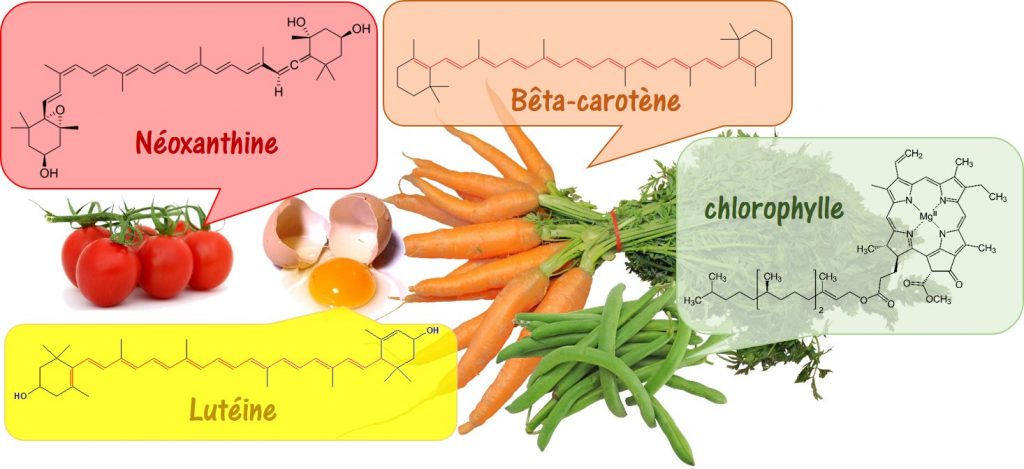
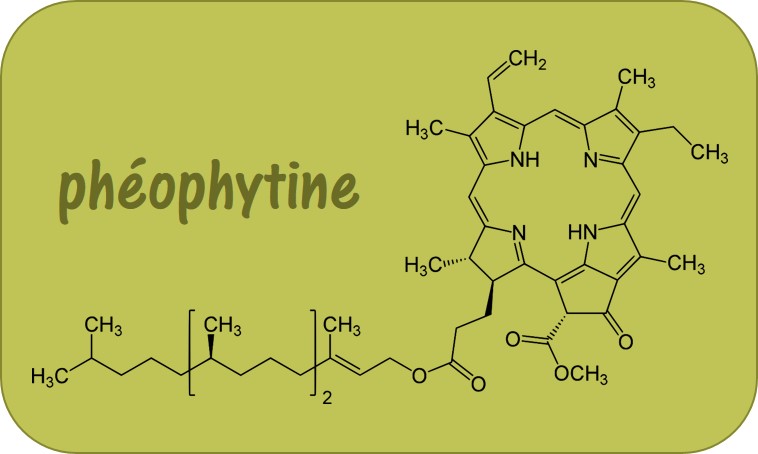
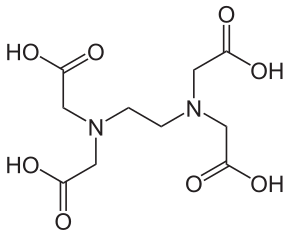
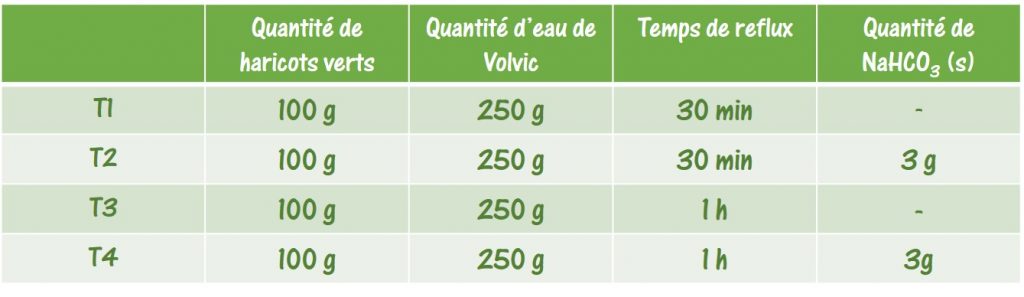
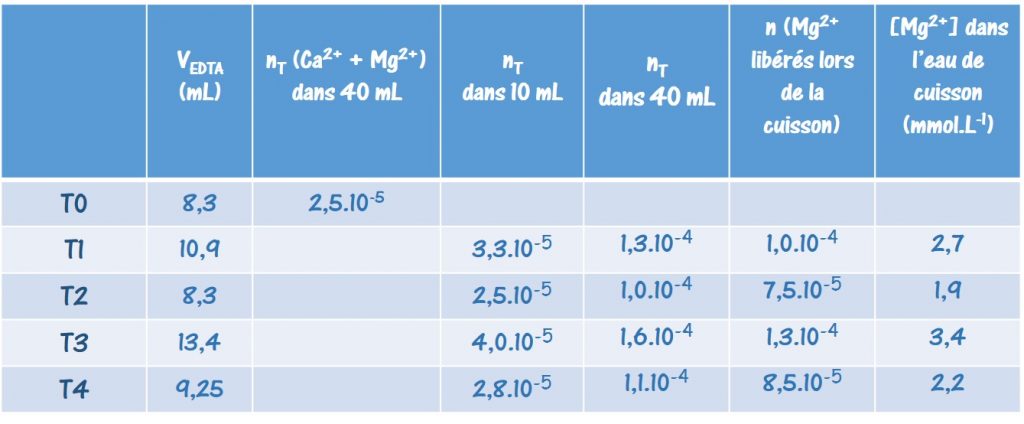
Les Ateliers Science & Cuisine sont des activités expérimentales en relation avec les programmes pédagogiques des lycées, créés à la demande de l’Inspection de l’Académie de Paris. Ils ne cessent de s’enrichir de nouvelles activités qui profitent de l’engouement des élèves pour l’activité de « cuisine », témoignée par la présence de programmes de télévision dans de nombreux pays du monde.
Ces ateliers se présentent sous la forme de fiches expérimentales, comprenant une partie pour les élèves et une partie pour les professeurs. Elles sont accessibles sur divers sites, tel celui de l’Académie de Paris ou celui du Centre International de Gastronomie Moléculaire AgroParisTech-Inra [1].
Hervé This nous introduit à cet atelier Science & Cuisine !

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie