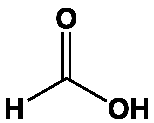
De formule CH2O2, ou mieux HCOOH pour faire ressortir la fonction acide carboxylique, il se présente sous forme d’un liquide incolore à odeur pénétrante. Bien qu’il soit plus ionisé que ses homologues supérieurs, c’est un acide faible, capable toutefois de déplacer l’acide nitrique de ses sels. Il ne donne ni halogénure d’acyle ni anhydride d’acide.
Dès le XVe siècle, quelques alchimistes et naturalistes avaient connaissance que certaines fourmis produisaient une vapeur acide. C’est le naturaliste anglais John Ray qui décrit en 1671 son isolation par distillation d’un grand nombre de cadavres de fourmis. On doit à Louis Joseph Gay-Lussac (cf. L.J. Gay-Lussac) sa première synthèse au départ de l’acide cyanhydrique. En 1855, Marcellin Berthelot, développa une méthode de synthèse à partir du monoxyde de carbone, encore utilisée de nos jours. Dans la nature l’acide formique se trouve dans le dard et les piqûres de plusieurs insectes de l’ordre des hyménoptères, mais aussi sur les poils qui composent les feuilles de certaines plantes de la famille des urticacées.

Les poils urticants des orties contiennent de l’acide formique, de l’histamine, de l’acétylcholine et de la sérotonine qui irritent la peau. Ces poils ont à leur extrémité une pointe de silice (cf. Silice) qui permet de pénétrer la peau des animaux qui s’en approchent trop. Les poils urticants de l’ortie sont aussi fragiles que du verre : ils se brisent comme l’extrémité des ampoules de médicaments et injectent dans la peau l’histamine qui provoque des rougeurs.
Une quantité significative d’acide formique était formée comme sous-produit de la fabrication de l’acide acétique (cf. Acide acétique) par oxydation des alcanes. Toutefois, les procédés de carbonylation du méthanol ont supplanté cette voie de synthèse, peu sélective. La carbonylation de la potasse effectuée par Marcellin Berthelot :
CO + KOH ———> HCO2K
suivie d’une hydrolyse en milieu acide sulfurique, est à la base des procédés industriels qui emploient le méthanol en présence d’une base forte :
CH3OH + CO ———> HCO2CH3
HCO2CH3 + H2O ———> HCO2H + CH3OH
ou d’ammoniac (cf. Ammoniac) :
HCO2CH3+ NH3 → HC(O)NH2 + CH3OH
2 HC(O)NH2 + 2 H2O + H2SO4→ 2HCO2H + (NH4)2SO4
L’étape difficile est l’hydrolyse du formiate de méthyle. Celle-ci peut être contournée par la réaction d’aminolyse qui conduit au formamide que l’on peut hydrolyser en présence d’acide sulfurique qui déplace la réaction vers le produit désiré, mais avec la formation de sulfate d’ammonium. Le formamide intermédiaire est aussi utilisé comme solvant et le sulfate d’ammonium, comme engrais.
L’hydrogénation catalytique du dioxyde de carbone (cf. Dioxyde de carbone) a été également étudiée et s’effectue au contact de complexes moléculaires du ruthénium.
CO2 + H2 ———> HCOOH
L’acide formique a longtemps été considéré comme un composé chimique d’intérêt industriel mineur. La capacité mondiale de production est de l’ordre de 500 kt/an. Il est commercialement disponible en solution de diverses concentrations entre 85 et 99%.
A l’échelle du laboratoire, l’acide formique est une source de monoxyde de carbone (décomposition par l’acide sulfurique), d’ion hydrure (réactions d’Eschweiler-Clarke et de Leuckart-Wallach) ou de dihydrogène pour les réactions par transfert d’hydrogène.
Il est utilisé dans les industries textiles et du cuir, en galvanoplastie et pour la formulation d’insecticides, laques, solvants et produits ménagers en substitut des acides minéraux («anticalcaire »). A l’état dilué, il est employé en alimentation humaine (additif alimentaire E236). Une utilisation importante de l’acide formique est comme agent de conservation et antibactérien en alimentation du bétail.
En Europe, il est appliqué sur le foin frais ou tout autre ensilage pour favoriser la fermentation de l’acide lactique et supprimer la formation de l’acide butyrique ; il permet également à la fermentation de se produire rapidement et à plus basse température, réduisant ainsi la perte de valeur nutritive. Dans l’industrie avicole, on l’ajoute parfois à l’alimentation pour détruire Escherichia coli. Les apiculteurs emploient l’acide formique comme acaricide (Acarapis woodi et Varroa destructor).
L’acide formique contient 53 g/L-1 de dihydrogène à température et pression ambiante, ce qui est deux fois la capacité du dihydrogène comprimé à 350 bar. C’est donc un vecteur de dihydrogène potentiel pour l’alimentation de piles à combustible. Des équipes suisse (EPFL, Lausanne) et allemande (LIK, Rostock) ont montré la décomposition de l’acide formique (HCOOH) en dihydrogène et dioxyde de carbone. Le dihydrogène peut ainsi être produit dans une large plage de pression (1-600 bars) et la réaction n’engendre pas de monoxyde de carbone, polluant des catalyseurs actuellement employés dans les piles à combustible.
Pensée du jour
Qui s’y frotte s’y pique : c’est l’acide formique !
Sources
– http://fr.wikipedia.org/wiki/Acide_méthanoïque
– http://en.wikipedia.org/wiki/Formic_acid
– www.inrs.fr/fichetox/ft149.html
– www.acideformik.com/forums/index.php?act=home
– http://fr.wikipedia.org/wiki/Solenopsis_invicta_(fourmi_de_feu)
– http://fr.wikipedia.org/wiki/Formicidae
– http://fr.wikipedia.org/wiki/Ortie
Pour en savoir plus
– Louis Joseph Gay-Lussac
– Silice
– Acide acétique
– Ammoniac
– Dioxyde de carbone

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie