Toute réaction chimique met en jeu un transfert d’électrons : c’est tout aussi vrai pour les processus présents dans les organismes vivants. En retournant l’expression favorite de Jean-Marie Lehn, Prix Nobel de Chimie 1987, « La Vie ? La Chimie ! », les processus redox qui les officient sont l’affaire du Nicotinamide Adénine Dinucléotide, généralement abrégé en NAD, et son homologue triphosphorylé, le Nicotinamide Adénine Dinucléotide Phosphate, NADP.
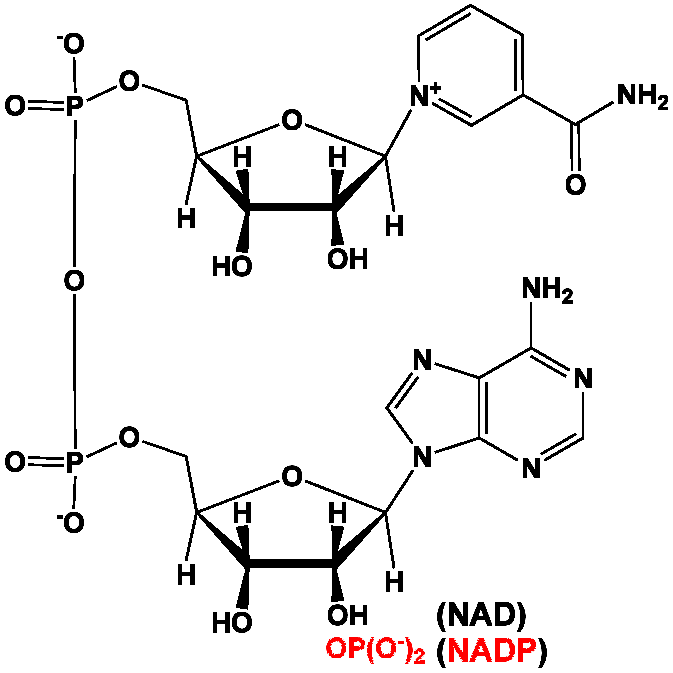
Le nicotinamide adénine dinucléotide est une coenzyme d’oxydoréduction présente dans toutes les cellules vivantes. Il est composé de deux nucléotides liés par leurs groupes phosphate. Un des nucléotides contient une adénine tandis que l’autre contient un nicotinamide. Dans le métabolisme, le NAD+ est impliqué dans les réactions redox en transportant des électrons. Cette coenzyme est présente sous deux formes dans la cellule : NAD+ est un agent d’oxydation et NADH, en association avec un proton H+, un agent de réduction. Ce rôle de transfert d’électrons est la principale fonction du système NADH/H+.
Le nicotinamide adénine dinucléotide phosphate (NADP) est très proche du NAD, dont il diffère par la présence d’un groupement phosphate sur l’atome de carbone C-2′ du {β-D-ribofuranose du résidu adénosine. Sa forme réduite est désignée par NADPH ou mieux encore NADPH+/H+.
Le coenzyme NAD+ a été découvert par les biochimistes britanniques Arthur Harden et William Youndin en 1906 : ils avaient observé que l’ajout d’extrait de levure bouilli et filtré accélérait fortement la fermentation alcoolique avec des extraits de levure non bouillis. Ils ont appelé co-ferment le facteur non identifié responsable de cet effet. Hans von Euler-Chelpin identifia ce facteur thermostable comme un nucléotide.
En 1936, Otto H. Warburg montra la fonction de transfert d’hydrure du coenzyme et identifia le résidu nicotinamide comme site de la réaction redox.
En 1949, les biochimistes américains Morris Friedkin et Albert L. Lehninger montrent que le NADH est lié à des voies métaboliques comme le cycle de l’acide citrique (cf. Acide citrique) et la synthèse de l’ATP par phosphorylation oxydante (cf. {ATP). Enfin, en 1959, les américains Jack Preiss et Philip Handler décrivent les intermédiaires et les enzymes impliquées dans la biosynthèse de NAD+. Les autres rôles du NAD(P), par exemple comme donneur d’ADP-ribose, sont une découverte récente.
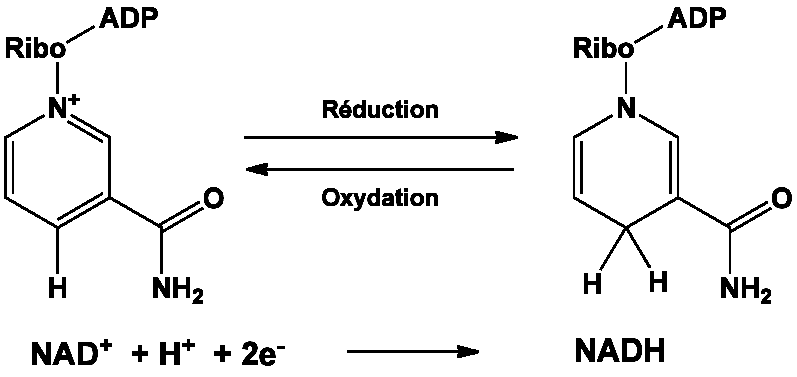
Dans le métabolisme, le substrat accepte ou donne des électrons dans des réactions redox. De telles réactions comportent le déplacement de deux atomes d’hydrogène du substrat SH2, sous forme d’un ion d’hydrure (H−) et d’un proton (H+). Le proton est relargué dans le milieu, alors que le substrat est oxydé et NAD+ réduit en NADH par le transfert de l’hydrure sur l’atome de carbone C-4 du cycle nicotinamide.
Le potentiel de la paire redox de NAD+/NADH est -0,32 V, qui fait de NADH un agent réducteur fort. La réaction est facilement réversible : le NADH réduit une autre molécule et est à nouveau oxydé en NAD+.
Sous ses deux formes, ce coenzyme se présente comme une poudre blanche, hygroscopique et fortement hydrosoluble. Les solutions de NAD+ sont incolores et stables pendant environ une semaine à pH neutre, mais se décomposent rapidement en milieu acide ou alcalin. Leur décomposition conduit à des produits qui sont des inhibiteurs d’enzyme. Du fait de la présence de noyaux aromatiques, les deux formes NAD+ et NADH absorbent fortement dans le domaine UV : 259 nm pour le NAD+ et 260 et 339 nm pour le NADH. Cette différence dans les spectres d’absorption, mais également dans les spectres de fluorescence (NAD+ n’émet pas en fluorescence) sont mises à profit dans les études cinétiques des réactions enzymatiques. Les variations de la fluorescence sont également exploitées en microscopie de fluorescence pour mesurer des changements de l’état redox des cellules vivantes.
L’équilibre entre les formes oxydées et réduites, exprimé par le rapport de NAD+/NADH, reflète les activités métaboliques et la santé des cellules. Dans les tissus sains des mammifères, ce rapport est de l’ordre de 700 dans le cytoplasme, favorable donc aux réactions oxydantes. Toutefois le rapport global NAD+/NADH est bien inférieur, avec des valeurs comprises entre 0,05 à 4. En revanche, le rapport de NADP+/NADPH est normalement d’environ 0,005, NADPH étant donc la forme dominante de ce coenzyme. Ces rapports différents expliquent les différents rôles de NADH et NADPH dans le métabolisme.
Le rôle principal de NAD+ dans le métabolisme est le transfert d’électrons d’une molécule à l’autre. Ces processus sont catalysés par un grand groupe d’enzymes appelées oxydoréductases, mais souvent désignées sous les noms de déshydrogénases ou de réductases. Dans l’association NAD+-oxydoréductase, le noyau nicotinamide du coenzyme est placé dans la poche enzymatique de sorte qu’il puisse accepter un atome d’hydrogène (« hydrure ») du substrat.
En dépit de la similitude dans le mode de fixation des deux coenzymes aux protéines, les enzymes présentent presque toujours un niveau élevé de spécificité pour NAD+ ou NADP+. Cette spécificité reflète les rôles métaboliques des deux coenzymes, conséquence des ensembles distincts de résidus d’acides aminés présents dans la poche liant le coenzyme. Par exemple, pour les enzymes NADP-dépendantes, une liaison ionique est formée entre une chaîne latérale d’acide aminé basique et le groupe phosphate acide de NADP+. À l’opposé, pour les enzymes NAD-dépendantes, la charge dans cette poche est inversée, empêchant l’accueil de NADP+.
Les réactions redox catalysées par des oxydoréductases sont essentielles dans toutes les domaines du métabolisme, mais une particulièrement importante concerne la production d’énergie à partir des aliments. Ainsi les composés comme le glucose (cf. Glucose) et les acides gras (cf. Acides gras) sont oxydés, libérant de ce fait de l’énergie. Cette énergie est transférée à NAD+ par réduction en NADH, en tant qu’élément de β-oxydation, de glycolyse et du cycle de l’acide citrique.
Dans les eucaryotes, les électrons portés par le NADH produit dans le cytoplasme, sont transférés dans les mitochondries pour réduire le NAD+ mitochondrique via les navettes mitochondriques, telles que le système malate-aspartate. Le NADH mitochondrique est alors oxydé par la chaîne de transport d’électrons, qui pompe des protons à travers une membrane et produit de l’adénosine triphosphate, ATP, par phosphorylation oxydante. Ces systèmes de navette ont la même fonction de transport dans les chloroplastes (cf. Chlorophylle).
Pensée du jour
« Sans NAD, nada la vida ! »
Pour en savoir plus
– Acide citrique
– ATP
– Glucose
– Acides gras
– Chlorophylle

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie