L’acide tartrique a été isolé la première fois dans le tartrate de potassium, décrit dès 800 par l’alchimiste Jabir ibn Hayyan sous le nom de tartre. Il fut isolé pour la première fois en 1769, par le chimiste suédois Carl Wilhelm Scheele, qui fit bouillir du tartre (bitartrate de potassium) avec de la craie et décomposa le produit en présence d’acide sulfurique.
L’acide tartrique a joué un rôle important dans la découverte de la chiralité chimique. Jean Baptiste Biot a observé cette propriété de l’acide tartrique en 1832 en constatant sa capacité à faire tourner le plan de la lumière polarisée. Louis Pasteur a poursuivi cette recherche en 1847 en étudiant la morphologie des cristaux de tartrate double de sodium et d’ammonium. En séparant manuellement les cristaux dimorphes, il fut le premier à obtenir un échantillon pur d’acide L-(+)-tartrique.
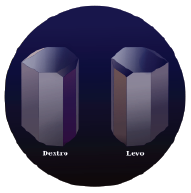
L’acide tartrique naturel est chiral, ce qui signifiant qu’il est constitué de molécules dont l’image dans un miroir ne lui est pas superposable. Pour simplifier les choses, l’acide naturel, L-(+), est évidemment dextrogyre et l’autre énantiomère, D-(-), lévogyre : en fait les configurations D ou L sont dérivées des configurations des D ou L glycraldéhydes et les notations dextrogyre (d) et lévogyre (l) à l’orientation du plan de polarisation de la lumière, respectivement (+) et (-). L’acide mésotartrique ne doit pas être confondu avec l’acide racémique, mélange 1:1des énantiomères D-(-) et L-(+).
Issu de résidus viticoles recyclés, l´acide tartrique est produit dans les pays viticoles. Le marché mondial est estimé à 35 000 tonnes. Jusqu’en 2000, ces prix ont subi de fortes fluctuations du fait de son origine naturelle. Mais depuis cette date, ils sont en chute importante, car l´acide tartrique naturel est confronté au développement de la voie de synthèse, notamment en Chine qui produit actuellement 5 000 t/an.
Ses applications vont de l´alimentation (boissons, confiseries et dans la levure de panification à hauteur de 25 %), à la viticulture (pour corriger l´acidité des moûts), en passant par l´industrie pharmaceutique en raison de son fort pouvoir acidifiant et l´industrie du plâtre (comme retardateur de durcissement) où son application représente environ 20 % du marché mondial.
Les dérivés importants de l’acide tartrique incluent ses sels répondant aux noms de crème de tartre (bitartrate de potassium), du sel de Rochelle (tartrate de sodium et de potassium, un laxatif doux), et d’émétique de tartre (tartrate de potassium et d’antimoine, cf. Antimoine).
Il est utilisé comme acide solide dans les comprimés effervescents contre les indigestions et les maux de tête. Lorsqu’on les met dans l’eau, l’acide se dissout et réagit avec le bicarbonate de sodium pour libérer du dioxyde de carbone gazeux. Il est utilisé dans l’alimentation comme additif alimentaire (E334), principalement comme antioxydant, régulateur de pH et séquestrant. Il est autorisé dans la plupart des produits alimentaires et dans certains produits spécifiques tels que les produits de cacao et de chocolat, les confitures et gelées, les fruits et légumes en conserve.
Les solutions aqueuses de crème de tartre servent à nettoyer les pièces de monnaie en cuivre en dissolvant la couche d’oxyde de cuivre(II) formé à la surface de la pièce de monnaie, le complexe résultant de étant facilement soluble dans l’eau.
C’est une matière première utile en chimie organique pour la synthèse de ligands chiraux :
– le tartrate d’isopropyle est le ligand employé en catalyse énantiosélective d’époxydes chiraux au départ d’alcools allyliques, réaction qui valut à K. Barry Sharpless de partager le Prix Nobel de Chimie 2001,
– la DIOP ({DIphosphine OPtiquement active) préparée par Henri Kagan fut le premier ligand chiral de symétrie C2 employé en catalyse d’hydrogénation énantiosélective (cf. Rhodium).
L’acide tartrique est le principal acide organique qui confère l’acidité au vin. Il est immédiatement reconnaissable de l’amateur par les petits cristaux de bitartrate de potassium qui se forment parfois spontanément sur le bouchon de liège ou déposé sur le culot de la bouteille. L’acide tartrique joue un rôle important en abaissant le pH lors de la fermentation du moût à un niveau où beaucoup de bactéries indésirables ne peuvent pas se développer, et à agir en tant que conservateur après fermentation. En bouche, l’acide tartrique fournit une partie de l’âpreté du vin, bien que les acides citrique et malique interviennent également.
Son utilisation en viticulture est en France très contrôlée. Dans ce secteur, la consommation d’acide tartrique peut varier énormément en fonction des conditions climatiques. La part de la viticulture varie entre 20 et 35% de la demande annuelle : il fut très utilisé en 2003, année de la canicule. Le marché français représente un millier de tonnes.
Pensée du jour
« Les « diamants du vin » ne sont pas des éclats de verre, mais des cristaux de bitartrate de potassium »
Sources
– http://fr.wikipedia.org/wiki/Acide_tartrique
– http://en.wikipedia.org/wiki/Tartaric_acid
– http://fr.wikipedia.org/wiki/Bitartrate_de_potassium
– www.viticulture-oenologie-formation.fr/vitioenoform.fr

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie