De son vrai nom adénosine triphosphate, l’ATP est un mononucléotide diphosphorylé du métabolisme intermédiaire découvert en 1929 par Karl Lohmann. Véritable « monnaie énergétique de la cellule » pour reprendre l’expression du biochimiste Albert Szent-Gyorgýi, ce composé assure la fourniture d’énergie pour la plupart des réactions assurant le fonctionnement de tout être vivant. Son rôle dans le transport de restes phosphoryle est également essentiel.
L’ATP est constitué d’adénine unie par une liaison N-osidique à une molécule de ribose (β-D-ribofurannose) elle-même phosphorylée en C-5. La molécule comporte trois restes phosphoryle unis par des liaisons anhydride d’acide. Seules les deux dernières liaisons constituent ce que Fritz Albert Lipmann a désigné sous le terme de « liaison riche en énergie », c’est-à-dire comportant une énergie potentielle chimique facile à libérer ou à transférer.
La réaction d’hydrolyse de l’adénosine triphosphate en adénosine diphosphate, ADP, et phosphate inorganique, HPO42- (ou Pi) est une réaction exergonique dont la variation d’enthalpie libre standard est de -30,5 kJ/mol :
ATP + 2 H2O ———> ADP + Pi + 2 H3O+
La réaction d’hydrolyse de l’ATP en adénosine monophosphate, AMP, et pyrophosphate inorganique HP2O73- est une réaction encore plus exergonique dont la variation d’enthalpie libre standard est de -45,6 kJ kJ/mol :
ATP + 3 H2O ———> AMP + PPi + 3 H3O+
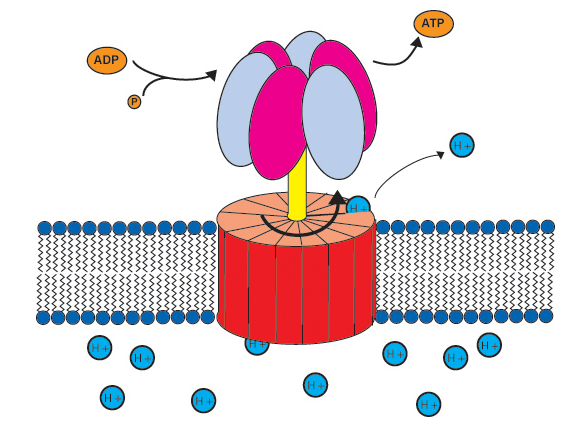
L’ADP peut être phosphorylée au moyen de l’ATP synthétase (ou synthase) qui est un complexe protéique enzymatique se trouvant dans les crêtes mitochondriales, la membrane des thylakoïdes des chloroplastes (cf. Chlorophylle), et la membrane plasmique des bactéries et des archéobactéries.
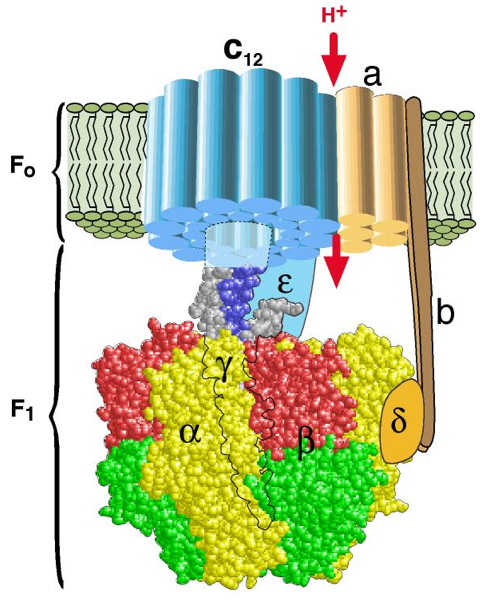
Le rôle de cette protéine membranaire est de synthétiser l’ATP à partir du gradient de pH. La microscopie électronique et les études cristallographiques révèlent que l’ATP synthétase est une véritable nanomachine comprenant trois parties :
– la base F0, enfouie dans la bicouche lipidique de la membrane porteuse,
– la « projection en forme de bouton de porte » F1. Cette projection piriforme, d’environ 10 nm de diamètre est portée par un pédicelle de 3 à 5 nm de diamètre et 5 nm de longueur environ. F0 et F1 sont solidaires et peuvent pivoter sur un axe perpendiculaire à la membrane qui les porte : ils forment le « rotor » de l’ATP-synthétase,
– un autre ensemble protéique forme le « stator » immobile de l’enzyme (b) : cet ensemble, partiellement en anneau autour de F0 (a), est percé de deux canaux à protons H+, permettant à ces ions de traverser la membrane en empruntant la fente séparant rotor et stator.
Le « rotor » (F0, F1) est mis en mouvement par la circulation des protons à travers a, comme une roue de moulin à eau. Les sites catalytiques pour la liaison de l’ADP et Pi se trouvent dans les sous-unités ß de la protubérance F1 qui peuvent adopter trois conformations se succédant dans l’ordre : « lâche (L), serrée (S), ouverte (O) ». Chacune de ces unités est dans l’une de ces trois positions, la rotation les déforme et les rend ainsi aptes à la synthèse d’ATP. En conformation L, le site catalytique de β a une grande affinité pour ADP et Pi, ce qui provoque leur fixation.
En conformation S, il se resserre sur les substrats et les condense en ATP : l’énergie mécanique de contraction du site actif provoque la formation d’une liaison ester phosphorique entre ADP et Pi. Enfin, la conformation O, avec une décompression du site actif, permet la libération de l’ATP dans le milieu au contact avec F1 (stroma ou matrice mitochondriale). visualiser le mouvement
La synthèse de chaque molécule d’ATP exige une rotation de 120° du rotor et une rotation complète libère donc trois molécules d’ATP. Ce « rotor » tourne à la vitesse moyenne de 50 à 100 tours par seconde… Ce système convertit une énergie osmotique en énergie mécanique, elle-même utilisée pour recharger en énergie chimique l’ATP. L’énergie consommée par les cellules de l’organisme requiert l’hydrolyse de 100 à 150 moles d’ATP par jour, soit entre 50 et 75 kg. L’ATP ne peut pas être conservée par l’organisme, sa consommation suit étroitement sa synthèse : à l’échelle industrielle ce serait un produit captif. Seuls les intermédiaires de la chaîne de production de l’ATP peuvent être stockés : glycogène (cf. Glucose) dans le mode animal et amidon (cf. Amidon) dans le monde végétal.
Pensée du jour nostalgique
« Si l’ATP est toujours produit pour fournir l’énergie à l’organisme, les ATP d’un organisme bien connu ont muté en ANR qui n’a pas encore muté en ARN pour la reproduction des chercheurs ! »
Sources
– http://fr.wikipedia.org/wiki/Adénosine_triphosphate
– http://en.wikipedia.org/wiki/Adenosine_triphosphate
– http://fr.wikipedia.org/wiki/Adénosine_diphosphate
– http://en.wikipedia.org/wiki/Adenosine_diphosphate
– http://fr.wikipedia.org/wiki/Adénosine_monophosphate
– http://en.wikipedia.org/wiki/Adenosine_monophosphate
– http://fr.wikipedia.org/wiki/ATP_synthase
– http://en.wikipedia.org/wiki/ATP_synthase
– www.snv.jussieu.fr/bmedia/Photosynthese-cours/15-ATPsynthase.htm
– http://www.mrc-mbu.cam.ac.uk/research/atp-synthase/molecular-animations-atp-synthase
– www.videosurf.com/video/the-atp-synthase-enzyme-123296602?vlt=ffext&vlt_position=rightrail
Pour en savoir plus
– Chlorophylle
– Glucose
– Amidon

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie