Le baryum (du grec βαρυς ou barys, lourd) est un élément de symbole Ba et de numéro atomique 56. Sa masse atomique est M = 137,3 et sa densité à l’état métallique d = 3,62 g/cm3. C’est un métal alcalino- terreux qui fond à environ 730 °C. On ne le trouve pas à l’état natif, car comme pour les alcalino-terreux (Sr, Ca) il s’oxyde très rapidement en formant l’oxyde stable, BaO.
Les minerais de baryum se trouvent assez souvent près des sources d’autres métaux comme le magnésium (cf. Magnésium), le manganèse (cf. Manganèse) et des filons fluorés. Le minéral du baryum le plus répandu est la barytine ou sulfate de baryum, BaSO4, que l’on a longtemps considéré comme une gangue sans valeur avant que les alchimistes ne s’y intéressent au Moyen-Age. En 1630, le Bolognais Vincenzo Cascariolo chauffe la baryte et constate que dans l’obscurité elle rayonne. Cette luminescence causa grand émoi et les savants de l’époque nommèrent les agrégats de baryte « la boule lumineuse de Bologne ».
Les autres minéraux sont des mélanges de carbonates (Ba, Sr, Mn, Mg) comme la benstonite et aussi la norséthite, BaMg(CO3)2, la withérite, BaCO3 cristallisé. L’oxyde BaO, appelé baryte anhydre, se trouve souvent dans la barytine, accompagnant le sulfate. Cet oxyde de baryum a été découvert en 1774 par C. W. Scheele (cf. Carl W. Scheele) dans des minerais de dioxyde de manganèse (cf. Oxydes de manganèse).
Le baryum a été isolé en 1808 par Sir Humphry Davy et purifié par Guntz en 1901.
Le baryum étant très réactif vis-à-vis de l’oxygène est utilisé pour piéger les gaz dans les dispositifs sous vide comme les tubes cathodiques ou les capteurs thermiques à tube.
Les sels de baryum ont de nombreuses applications, on peut citer :
– Le chlorure de baryum, BaCl2, soluble dans l’eau, est préparé à partir de la barytine en deux étapes :
– à haute température
BaSO4 + 4 C ———> BaS + 4 CO
– puis par fusion de deux réactifs
BaS + CaCl2 ———> BaCl2 + CaS par fusion des réactifs
Le lavage à l’eau des produits de réaction donne une solution de BaCl2, ces solutions sont utilisées comme test de reconnaissance des ions sulfate dans les eaux :
BaCl2 + SO42- ———> BaSO4 + 2Cl–
On peut aussi précipiter d’autres sels insolubles tels que l’oxalate :
BaCl2(aq) + Na2C2O4(aq) ———> BaC2O4(sol) + 2 NaCl(aq)
Les solutions barytées sont aussi utilisées pour extraire le gaz carbonique d’un mélange de gaz par barbotage :
Ba(OH)2(aq) + CO2(gaz) ———> BaCO3(sol) + H2O
Le chlorure de baryum peut aussi être utilisé en pyrotechnie comme tous les sels de baryum pour colorer les flammes en vert (cf. Feux d’artifice).
Le sulfate de baryum, BaSO4, est le sel le plus insoluble connu. Il est obtenu par purification de la barytine et rencontre plusieurs usages. Il cristallise dans le système orthorhombique et forme des cristaux plats tabulaires parfois groupés en forme de rosettes de barytine à l’état naturel (cf. Accroche). Pur, il est de couleur blanche. Environ 75 % de la baryte sont utilisés pour rendre plus lourdes les boues de forages à grande profondeur pour l’exploitation du pétrole. Le sulfate de baryum est aussi utilisé comme pigment blanc dans les peintures et comme charge minérale dans les papiers. C’est aussi un opacifiant en radiologie compte tenu de la forte absorption des rayons X par cet élément.
Ce sont des suspensions de sulfate de baryum qui sont utilisées pour des radiographies de l’appareil digestif, car il reste insoluble même à l’épreuve des sucs acides de l’estomac (cf. Acide chlorhydrique).
Le titanate de baryum, BaTiO3, est un composé important pour l’électronique. C’est en effet le diélectrique principal avec des substitutions au strontium, Sr, ou zirconium, Zr dans la maille cristalline de type pérovskite. Le titanate de baryum a en effet la structure cubique qui peut être quadratique ou cubique en fonction de la température. La constante diélectrique de BaTiO3 est importante ε = 1 500 à 2 000 à température ordinaire, et monte à des valeurs importantes de l’ordre de ε = 12 000 au voisinage de la température de Curie (120 °C) qui accompagne la transition quadratique – cubique.
Dans la structure de type cubique, l’ion Ti4+ est en coordinence octaédrique (6) par rapport à l’oxygène et l’ion Ba2+, en coordinence dodécaédrique (12) par rapport à l’oxygène. Des substitutions du baryum par le strontium et des solutions solides avec l’homologue BaZrO3 permettent d’abaisser le point de Curie et d’obtenir des valeurs élevées et à peu près constantes entre 0 et 50 °C.
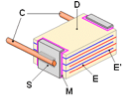
On dépose sur ces bandes des encres conductrices à base d’alliages Pd-Ag et on empile plusieurs couches avant découpage sous forme de petits cubes ou parallélépipède avant co-frittage autour de 1 300°C.
Dans les tubes hyperfréquences où la source d’électrons est une cathode poreuse de tungstène enduite d’oxyde de baryum chauffée à 1 050 °C, le baryum abaisse le seuil d’extraction des électrons et prolonge la durée de vie de la cathode.
Lorsque les sels de baryum sont absorbés par des organismes vivants, le baryum s’incruste dans les tissus en particulier dans les os. L’étude d’une exposition régulière au baryum menée chez des animaux montre une augmentation de la taille du foie et une diminution de la survie. Chez l’homme, l’intoxication aigue se manifeste par des douleurs abdominales intenses, des diarrhées et des troubles cardio-vasculaires. Elle peut provoquer la mort soit par insuffisance respiratoire, soit par arrêt cardiaque.
Pensée du jour :
«Si les bas résilles attirent les regards, le baryum titanate attire les charges.»
Sources :
– http://fr.wikipedia.org/wiki/Baryum
– Concise Encyclopedia of Advanced Ceramic Materials, R. J. Brook, Ed., Pergamon, Oxford 1991 (ISBN 0-08-034720-78)
– http://en.wikipedia.org/wiki/Barium
– http://elements.vanderkrogt.net/element.php?sym=ba
– www.periodicvideos.com/videos/056.htm
– http://en.wikipedia.org/wiki/Barium_sulfate
– http://en.wikipedia.org/wiki/Barium_titanate
– www.exxelia.com/index.php?id=20&fp_marque=1&fp_cat=7
Pour en savoir plus :
– Magnésium
– Manganèse
– Carl W. Scheele
– Oxyde de manganèse
– Feux d’artifice
– Acide chlorhydrique

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie