Après avoir démontré -en les brûlant- que le charbon et le diamant étaient tous deux constitués du même élément, c’est Lavoisier qui a donné son nom au carbone. Le carbone possède deux isotopes naturels stables : 12C (98,89 %) et 13C (1,11 %). L’isotope 12C a été choisi comme référence pour la masse atomique 12. Les deux radioisotopes les plus connus et exploités pour leurs propriétés sont le 14C à période longue (5 730 ans), employé pour la datation en archéologie afin d’évaluer l’âge des fossiles ou de toutes autres matières organiques, et le 11C à période courte (20 minutes) utilisé en imagerie médicale et médecine nucléaire.
Le carbone est présent sur la Terre depuis la formation de celle-ci, conséquence de l’explosion d’étoiles qui ont conduit à la formation du système solaire. Même s’il s’agit du quatrième élément le plus abondant de l’Univers, il est peu abondant (0,032 % de la croûte terrestre !), mais cela représente tout de même (en équivalent carbone) 810 Gt de dioxyde de carbone, 900 Gt de charbon, 150 Gt de pétrole et plus de 2 000 Gt de méthane de différentes origines.
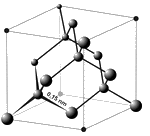
Dans la Nature, il existe à l’état pur, essentiellement sous deux formes allotropiques : le graphite et le diamant. Le diamant est du carbone pur cristallisé, stable sous très forte pression. Il se forme à une profondeur supérieure à 120-150 km et est donc d’origine volcanique : le magma en fusion, en raison de la forte pression, migre rapidement vers la surface, ce qui ne permet aux cristaux formés au sein d’une matrice de kimberlite de se transformer en graphite. Aux profondeurs plus faibles de la lithosphère, la forme stable du carbone est le graphite, dont l’espèce commune, plus ou moins pure, est le charbon. La nature de l’assemblage des atomes de carbone dans le réseau cristallin conduit à des variations étonnantes des propriétés :
-** le diamant est un assemblage compact tridimensionnel d’atomes de carbone, où chaque atome est fortement lié à 4 voisins. C’est un cristal blanc translucide, transparent aux rayons ultraviolets et infrarouges, extrêmement dur et c’est un isolant,
-** le graphite est formé de feuillets, assez espacés, d’atomes de carbone organisés en réseau nid d’abeilles, où chaque atome a trois voisins dans le même plan. Il est noir, mou, conducteur électrique.
De nouvelles formes allotropiques sont obtenues par synthèse et dérivent en fait du graphite :
– les fullerènes, dont le premier représentant a été identifié en 1985 comme étant un édifice composé de 60 atomes de carbones composés d’hexagones et de pentagones de carbone, analogue au ballon de football (d’où son nom commun footballène, plus facile à retenir que buckminsterfullerène), qui valurent à leurs découvreurs Richard Smalley, Robert Curl et Harold Kroto le Prix Nobel de Chimie 1996,
– le graphène, de préparation plus récente (2004), que l’on peut considérer comme un feuillet isolé de graphite Avec un atome d’épaisseur, c’est le cristal le plus fin du monde (0, 6 nanomètre !). Il existe sous forme de rubans dont le comportement électronique et la dureté sont inouïs. C’est le meilleur conducteur de chaleur identifié à ce jour et un très remarquable conducteur de l’électricité. Le Prix Nobel de Physique 2010 a récompensé leurs inventeurs Andrei Geim et Konstantin Novoselov.
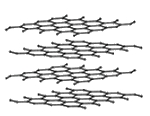
– les nanotubes mono- et surtout multifeuillets que l’on peut considérer comme résultant de l’enroulement d’une feuille de graphène sur elle-même possédant une hélicité régissant les propriétés physiques de ces nanomatériaux déjà produits à l’échelle pilote au niveau industriel.
Le carbone possède la caractéristique unique de former de longues chaînes de ses propres atomes. La force des liaisons carbone-carbone permet l’existence d’un nombre gigantesque de formes moléculaires dont beaucoup ont un rôle essentiel dans les processus vitaux. Ses particularités et la diversité des liaisons covalentes qu’il peut nouer avec d’autres éléments chimiques sont à la base d’une multitude de composés pouvant contenir, outre le carbone, un grand nombre d’atomes comme l’hydrogène, l’oxygène, l’azote, les halogènes, etc. Le tout constitue la chimie organique et mène à la chimie du vivant. Le carbone forme ainsi avec l’hydrogène la très vaste famille des hydrocarbures.
Par combustion en présence d’oxygène, il conduit aux dioxyde (CO2) et monoxyde de carbone (CO), largement évoqués dans les problèmes de changement climatique et de pollution (cf. les fiches correspondantes). Une autre famille couramment rencontrée dans la nature est celle des carbonates, les plus représentatifs étant les carbonates de calcium (CaCO3) et de sodium (Na2CO3).
Le carbone est utilisé dans de multiples applications industrielles comme vecteur d’énergie (charbon), comme pigment noir dans les encres et peintures, en joaillerie (diamants), agent de traitement de surfaces (polissage au diamant synthétique), comme précurseurs de fibres pour matériaux composites à hautes performances ou comme lubrifiant (graphite). En sidérurgie, le carbone, réducteur du minerai de fer, sert depuis fort longtemps à la fabrication de la fonte et de l’acier. Il existe aussi des textiles à base de fibres de carbone.
Le carbone qui est à la base de la vie sur Terre, est connu depuis l’antiquité, mais il continue de donner lieu à d’exceptionnelles découvertes et voilà comment le plus ancien «matériau sur Terre» produit de nouvelles avancées !
D’où la pensée du jour
« Comment faire du neuf avec le vieux charbon ? Avec la Chimie ! »
Sources
– http://fr.wikipedia.org/wiki/Carbone
– http://villemin.gerard.free.fr/Scienmod/Carbone.htm#Carbone
– http://en.wikipedia.org/wiki/Carbon
– http://fr.wikipedia.org/wiki/Lonsdaléite
– http://en.wikipedia.org/wiki/Lonsdaleite
– http://fr.wikipedia.org/wiki/Diamant
– http://en.wikipedia.org/wiki/Diamond
– http://fr.wikipedia.org/wiki/Graphite
– http://fr.wikipedia.org/wiki/Graphène
– http://en.wikipedia.org/wiki/Graphene
– http://fr.wikipedia.org/wiki/Fullerène
– http://en.wikipedia.org/wiki/Fullerene
– http://fr.wikipedia.org/wiki/Nanotube_de_carbone
– http://en.wikipedia.org/wiki/Carbon_nanotube
– www.periodicvideos.com/videos/006.htm

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie