L’identification d’un pigment jaune orangé (le « P ») dans des fractions microsomales hépatiques de rat et de cochon remonte à 1958. La dénomination « P450 » a été attribuée pour l’absorption intense dans le spectre visible à 450 nm lorsque le fer de l’hème (cf. Porphyrines), à l’état réduit, est complexé au monoxyde de carbone. La fonction biochimique des cytochromes P450 fut établie vers le début des années 60 aussi bien dans la biotransformation des stéroïdes que dans l’oxydation des composés exogènes.
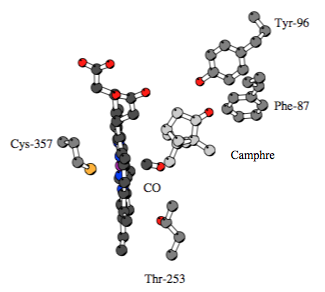
La raison de l’absorption spécifique à 450 nm provient de la nature particulière du ligand lié à l’hème : il s’agit d’un ligand thiolate issu d’une cystéine (dite proximal par opposition au sixième ligand -distal- porté par l’ion fer) de l’apoprotéine qui entoure l’hème et la fixe ainsi à la paroi membranaire de la cellule.
On recense actuellement 11 500 hémoprotéines CYP, répartis dans trois familles (CYP1, CYP2 et CYP3). On distingue également des sous-familles (CYP1A, CYP2D…) et des isoenzymes distinctes (CYP3A4, CYP2D6…). Pour compliquer la situation, les gènes codant ces enzymes sont également appelées CYP, abréviation suivie du chiffre arabe indiquant la famille, une lettre indiquant la sous-famille et un autre chiffre associé au gène individualisé. Pour différencier gène codant et enzyme, il est convenu d’écrire en italique la référence au gène : ainsi le gène CYP2E1 code l’enzyme CYP2E1, une des enzymes impliquée dans le métabolisme du paracétamol. Chaque type de cytochrome P450 a une fonction différente, par exemple :
– CYP2C9 intervient dans le métabolisme de la plupart des anti-inflammatoires non stéroïdiens, des antidiabétiques oraux, des anticoagulants oraux (acénocoumarol, warfarine), de la phénytoïne (anticonvulsif) et d’antihypertenseurs (losartan),
– CYP2D6 intervient dans le métabolisme de la codéine en morphine, de certains antiarythmiques et antidépresseurs, des bêta-bloquants et de neuroleptiques,
– CYP1A2 intervient dans le métabolisme de la caféine (cf. Caféine) et de la théophylline (cf. Chocolat), de l’imipramine et du paracétamol.
Les réactions de biotransformation des xénobiotiques catalysées par les CYPs s’inscrivent dans un processus de détoxication évitant l’accumulation de substances potentiellement toxiques dans l’organisme. La réaction globale s’écrit :
RH + O2 + 2H+ + 2 e– → ROH + H2 O
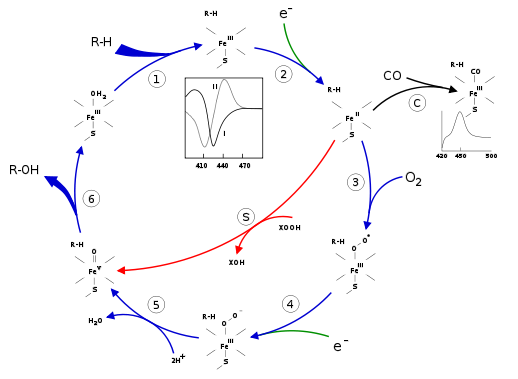
Le cycle catalytique d’oxydation débute par l’interaction du substrat avec le site actif qui induit une modification de la conformation de ce dernier provoquant un changement de l’état de l’ion fer de l’hème de bas-spin à haut-spin. Ce changement favorise le transfert d’un électron à partir NAD(P)H par l’intermédiaire d’une réductase ramenant le fer ferrique à l’état ferreux.
Dans cet état réduit, il y a fixation du dioxygène en position axiale distale du fer(II). Le ligand thiolate fournit par une cystéine est un meilleur donneur d’électrons que l’histidine, qui est l’amino-acide le plus fréquemment rencontré dans hémoprotéines.
Un deuxième électron est transféré par l’intermédiaire du système transporteur d’électrons (cytochrome P450 réductase, ferredoxine, ou cytochrome b5), conduisant à la formation d’un ligand peroxo de courte de courte durée de vie.
Ce ligand peroxo est protoné à deux reprises par transfert à partir de l’eau ou d’aminoacides environnants de la protéine, libérant une molécule d’eau, et formant un réactif, appelé « composé I ». Cette espèce, récemment observée {in situ, serait un fer(IV) oxo, espèce ferryle liée à un ensemble hème-thiolate comportant une charge négative délocalisée.
C’est cette espèce ferryle qui assure l’hydroxylation du substrat RH. Après libération de du produit hydroxylé, l’enzyme revient à son état initial par coordination d’une molécule d’eau occupant cette position distale de l’ion Fe(III) de l’hème.
L’étude du mécanisme d’action a été simplifiée par le recours à l’emploi de donneurs d’oxygène simples comme les peroxydes ou plus simplement l’hypochlorite de sodium, court-circuitant les étapes 3, 4 et 5 engendrant l’espèce ferryle : c’est le « shunt peroxyde ».
Ce mécanisme montre la complexité des mécanismes mis en jeu, puisque pour fonctionner les CYPs requièrent toute une machinerie délivrant l’oxygène, les électrons (l’énergie ultime…), les protons et l’eau.
Pensée du jour
« Si tôt arrivé dans le foie, cytochrome P450 ! »
Sources
– http://en.wikipedia.org/wiki/Cytochrome
– http://fr.wikipedia.org/wiki/Cytochrome_P450
– http://tel.archives-ouvertes.fr/docs/00/44/72/15/PDF/These_Nguyen_Thien-An_2007_CEA-iBiTec-S.pdf
– http://en.wikipedia.org/wiki/Cytochrome_P450
– http://drnelson.uthsc.edu/CytochromeP450.html
– www.p450cytochrome.com/
Pour en savoir plus
– Porphyrines
– Caféine
– Chocolat

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie