Une porphyrine est un macrocycle hétérocyclique constitué de quatre sous-unités de pyrrole jointes sur les carbones α par quatre ponts méthine. Ces macrocycles sont des systèmes conjugués possédant au total 22 électrons π. Ce caractère aromatique confère aux porphyrines une stabilité thermodynamique importante et une forte absorption dans le domaine du spectre visible, conduisant à des couleurs intenses variant avec la nature des substituants. Le macrocycle non substitué est la porphine (R = H), et ses dérivés substitués s’appellent les porphyrines. Plusieurs autres macrocycles s’apparentent aux porphyrines, comme les chlorines, les corrines, les bactériochlorophylles, etc. Les chlorines comportent une sous-unité pyrroline et se rencontrent dans la chlorophylle (cf. {Chlorophylle, à paraître). Le remplacement de deux des quatre sous-unités pyrroliques par des sous-unités pyrroliniques conduit aux bactériochlorines, présentes dans les bactéries photosynthétiques, ou isobactériochlorines, selon les positions relatives des cycles partiellement réduits. Les corrines ne possèdent que trois ponts méthine et se rencontrent dans la vitamine B12.
Au laboratoire, les voies de synthèses, toutes basées sur la méthode de Rothemund, ont évolué au cours du temps, mais les constituants de base sont les mêmes : le pyrrole et un aldéhyde. Des conditions acides sont essentielles : les acides formique, acétique et propionique sont les solvants typiques, mais d’autres acides de Brønsted ou de Lewis associés à un solvant non acide peuvent être employés. Un grand nombre de sous-produits étant formés, le produit brut est purifié par recristallisation ou, mieux, chromatographie.
Les porphyrines peuvent se combiner avec de nombreux métaux venant occuper la cavité centrale. Par perte des protons portés par les deux atomes d’azote, une porphyrine [Por] lie un ion métallique pour former un complexe. Cet ion métallique possède généralement une charge 2+ ou de 3+ :
H2[Por] + [MLn]2+ → M[Por]Ln-4 + 4 L + 2 H+
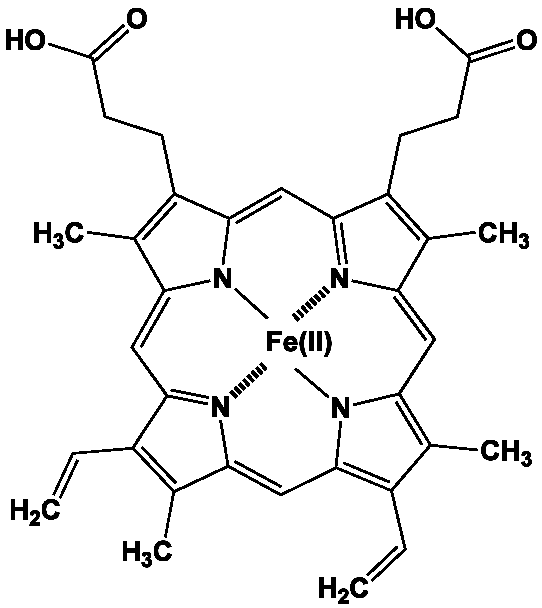
|Quelques porphyrines associant le fer s’appellent hèmes. Les protéines contenant un hème, les hémoprotéines, sont très répandues dans la nature. L’hémoglobine (cf. {Hémoglobine) et la myoglobine sont deux hémoprotéines comportant la protoporphyrine IX, principale porphyrine du règne animal, liant le dioxygène. Les cytochromes (cf. {Cytochrome P450 à paraître) sont également des hémoprotéines.
Bien que les complexes naturels de porphyrine soient essentiels pour la vie, les porphyrines synthétiques et leurs complexes ont une utilité limitée. L’emploi de colorants à base de porphyrines est restreint et on leur préfère les colorants à base de phtalocyanines sur lesquels on reviendra. On peut toutefois signaler l’emploi en essais cliniques de porphyrines substituées (par exemple, la photofrine) comme photosensibilisateurs en traitement photodynamique peu invasif de destruction des cellules cancéreuses. Par l’action d’un faisceau laser engendrant via ces photosensibilisateurs du dioxygène singulet, forme hautement toxique du dioxygène (cf. {Dioxygène), il y a destruction des cellules cancéreuses environnant la cible illuminée.
Pensée du jour
« {Par leur pourpre impériale, les porphyrines dominent le monde animal. »
Sources
– http://fr.wikipedia.org/wiki/Porphyrine
– http://en.wikipedia.org/wiki/Porphyrin
– http://fr.wikipedia.org/wiki/Porphyrie
– http://fr.wikipedia.org/wiki/Chlorophylle
– http://fr.wikipedia.org/wiki/Vitamine_B12
– http://en.wikipedia.org/wiki/Phthalocyanine
– www.pharmainfo.net/reviews/porphyrins-dynamic-photosensitizer-photodynamic-therapy
Pour en savoir plus
– Hémoglobine
– Dioxygène

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie