Le savon est le sel de sodium ou de potassium d’un acide gras, obtenu au cours d’une réaction qui s’appelle la saponification. Les molécules de savon ont une structure particulière constituée d’une longue chaîne organique de 12 à 18 atomes de carbone liée à un groupement carboxylate polaire. Cette structure leur confère un caractère amphiphile capable de modifier sensiblement les tensions de surface des fluides aqueux. Il s’ensuit les propriétés bien connues de formation de mousses, d’émulsions, de fixation des graisses, très utiles pour le lavage.
Les savons sont bien connus au moins depuis deux millénaires avant notre ère, les phéniciens le fabriquaient déjà à partir d’huile d’olive et de soude, cette dernière obtenue à partir de cendres de végétaux, notamment de lauriers. Ils l’exportaient sur tout le bassin méditerranéen. Selon Pline cependant, le savon serait une invention gauloise (cocorico !) et il décrit les savons durs et les savons mous. En latin, l’accusatif « {saponem » a donné en français savon. La fabrication se fait alors à partir de cendres alcalines, de suif, de saindoux de sanglier(non grillé par Obélix) ou d’huile non combustible. Il est aussi mélangé à du beurre ou à de la glycérine pour la toilette, notamment le lavage et la teinture des cheveux.

En 1789 on y comptait 65 fabriques soit 280 chaudières (cuves de réaction) pour une production de 22 000 tonnes.
Après une ruine sans précédent due à la période révolutionnaire, ce n’est qu’après 1800 et l’émergence du procédé Leblanc (cf. Acide chlorhydrique) de fabrication de la soude à partir du sel de mer que la production redémarre pour atteindre vers 1820 une valeur comparable, date coïncidant à peu près à l’explication de la réaction de saponification par Eugène Chevreul.
On compte alors plus de 90 fabriques et une production de plus de 90 000 tonnes atteinte vers 1880. La progression continue et avec le développement industriel, la production record de 180 000 tonnes en 1914 en sera le sommet, car la Première Guerre voit l’effondrement de la fabrication et du commerce de plus de 2/3. Après la guerre, les huileries absorbent progressivement les savonneries marseillaises, l’emballage, la « réclame » apparaissent, l’électricité, la vapeur se généralisent et la productivité augmente, mais les crises successives font tomber la production à 120 000 tonnes en 1938. Dès 1945 la technologie évolue, les détergents synthétiques font leur apparition, et la concurrence devient sévère : le savon de Marseille est concurrencé par quantités d’autres produits et devient un produit de niche.
Qu’est ce que la saponification ?
C’est une hydrolyse alcaline des corps gras par une base forte comme la soude :
On peut aussi utiliser la potasse, KOH. La réaction a lieu entre 80 et 100°C, pratiquement à ébullition. On pratique couramment l’hydrolyse des graisses ou huiles sous pression à plus haute température. On lave ensuite le produit surnageant pour enlever toute trace d’huile et de soude. Le glycérol (cf. Glycérol) est un sous-produit que l’on peut éliminer ou rajouter pour obtenir de meilleures propriétés hydratantes.
Les ajouts sont nombreux : agents anticalcaires pour éviter des précipités dans des eaux dures qui sont souvent des complexants comme l’EDTA, colorants, parfums, huiles essentielles, agents hydratants comme la glycérine.
Pourquoi se servir de savon pour se laver ?
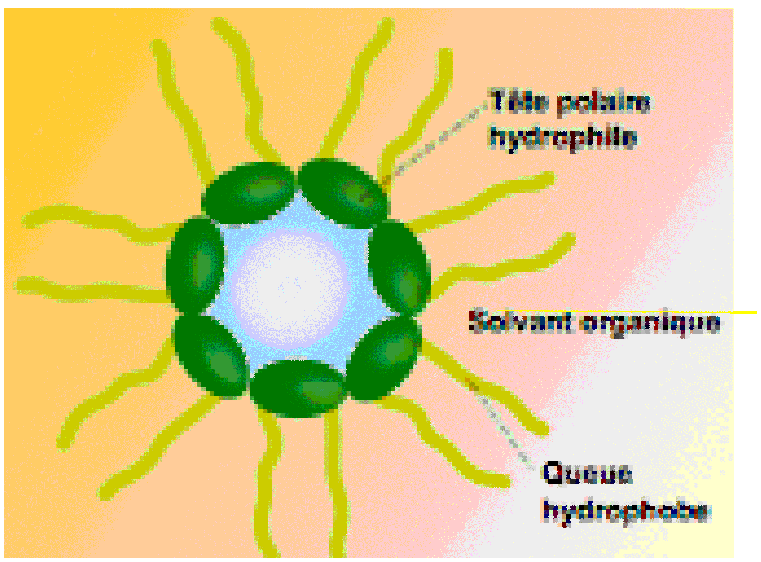
Le principe du lavage est dû à sa nature amphiphile, la chaîne carbonée longue est hydrophobe et cette « queue » d’acide gras se mêle aux graisses. A l’autre extrémité, le groupe carboxyle est polaire, donc hydrophile, et minimise son énergie au contact de l’eau.
La queue extrait les taches de graisse du tissu et l’enveloppe dans des gouttelettes ou micelles qui se forment et qui finissent par être entraînés par l’eau de lavage. Pour la toilette, le principe est le même, le savon dissous la graisse du film hydrolipidique en surface de la peau et entraîne de la même façon les saletés superficielles qui sont éliminées par l’eau de rinçage. Le film hydrolipidique se reconstitue en quelques heures pour protéger la peau.

– le savon noir préparé à partir d’huile de lin et de potasse,
– le savon d’Alep, le plus ancien savon syrien, préparé à partir d’huile d’olive, de beurre de baies de laurier et de soude, auquel on prête des propriétés anti-bactériennes.
Pensée du jour
« Si vous craignez un savon de votre patron, avant, savonnez lui la planche »
Sources
– http://fr.wikipedia.org/wiki/Savon
– http://fr.wikipedia.org/wiki/Amphiphile
– http://en.wikipedia.org/wiki/Amphiphile
– http://fr.wikipedia.org/wiki/Savon_de_Marseille
– http://fr.wikipedia.org/wiki/Micelle
Pour en savoir plus
– Acide chlorhydrique
– Glycérol

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie