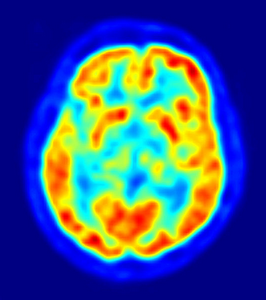
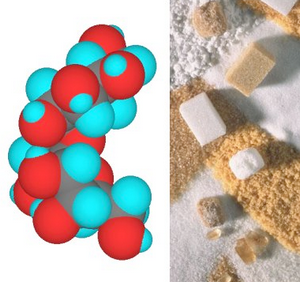
Il est constitué de cations sodium (Na+) et d’anions chlorure (Cl–) qui s’assemblent par interactions électrostatiques en une structure périodique où chaque cation est entouré de manière symétrique par six anions ({un octaèdre). Ce sont les rayons X qui permettent de décrire cette structure cristalline et de mesurer la distance qui sépare le cation Na+ de l’anion Cl–.
Le chlorure de sodium est l’un des plus abondants minéraux de la planète : on estime ses réserves à 50 millions de milliards de tonnes, présentes à l’état solide ({le sel gemme) dans le sous-sol ou en solution ({l’eau salée) dans les océans. Les marais salants assurent, par évaporation de l’eau, l’augmentation de la concentration en chlorure de sodium qui sédimente lorsqu’une teneur critique est atteinte.
L’utilisation du chlorure de sodium pour le salage des routes s’explique par le fait que température de solidification de l’eau salée est fonction de la concentration en sel : le diagramme de phase eau-sel montre que l’on peut maintenir un état liquide jusqu’à -21°C à condition d’avoir 23 % de sel en mélange avec l’eau.
Enfin, n’oublions pas qu’un produit aussi simple que le chlorure de sodium joue un rôle essentiel dans tous les organismes vivants. Un peu de sel exalte le goût des aliments, les cations sodium stimulant les papilles et les anions chlorure produisant le goût salé. Par contre, trop de sel conduit à l’hypertension !
Sources :

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie