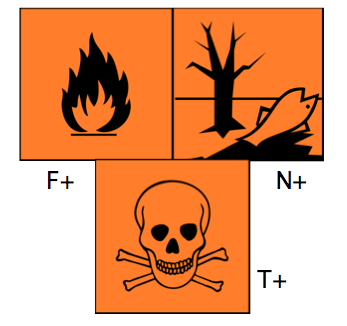
Le sulfure d’hydrogène ou hydrogène sulfuré, de formule H2S et de masse moléculaire M = 54, est un gaz très reconnaissable à son odeur qualifiée de « nauséabonde » qui est celle des œufs pourris. En plus des gaz émis par les volcans et les sources chaudes, il est présent dans les pétroles bruts, le gaz naturel.
En laboratoire on peut le synthétiser par l’action de l’acide chlorhydrique sur le sulfure de fer : FeS + 2 HCl ———> H2S + FeCl2
De nombreux chimistes ont utilisé au cours de leurs études, en TP de chimie analytique, lors de la recherche des anions et cations, des appareils de Kipp, générateurs de sulfure d’hydrogène, qui permet, par barbotage en solution, de précipiter les sulfures métalliques.
Le sulfure d’hydrogène peut être émis au cours d’opérations industrielles telles que le raffinage et le craquage des pétroles riches en soufre, l’hydrodésulfuration du pétrole et du charbon, la captation et l’épuration du gaz naturel (cf. Méthane), le forage de puits, notamment pour la production d’énergie géothermique.
L’hydrogène sulfuré a un rôle essentiel dans le cycle biologique du soufre, car il est produit par fermentation anaérobie de la matière organique sous l’action de bactéries sulfato-réductrices. Il est ainsi émis des sédiments marins, des marais, des eaux stagnantes, des excréments, des égouts et d’anciens gisements de gypse (cf. Plâtre).
C’est un gaz extrêmement toxique, mais à l’inverse du monoxyde de carbone (cf. Monoxyde de carbone) notre odorat le détecte à des teneurs très faibles de l’ordre de la partie par million (ppm, 0,0001%) : on sent l’odeur d’œuf pourri. A 10 ppm (0,001 %), il irrite les yeux et donne une sensation de brûlure aux poumons. A 100 ppm, on perd l’odorat et à 200 ppm le nerf olfactif est paralysé, d’où la perte de l’odorat qui ajoute au danger.
Au-delà, c’est la perte de connaissance et l’arrêt respiratoire et à 0,1 % c’est la mort par asphyxie et arrêt cardiaque. Chaque année des accidents dus à l’imprudence ou à la méconnaissance de ces dangers sont relatés par la presse, à la suite de la descente d’ouvriers pour le curage de puits ou de cuves susceptibles de contenir ce gaz en atmosphère confinée. Ils sont victimes de ce que l’on a appelé « le plomb du vidangeur », compte tenu de l’altération du sens olfactif.
Certains paléontologues expliquent l’extinction de la vie permo-triasique il y a 250 millions d’années par la présence massive de sulfure d’hydrogène dans un scénario qui pourrait rejoindre une certaine actualité au XXIe siècle ! Il y a 250 millions d’années, la terre connaît un réchauffement climatique qui provoque l’arrêt des courants océaniques alimentés comme on le sait par la descente aux pôles des eaux froides. Les pôles se réchauffant, l’arrêt des courants qui s’ensuit entraîne la stagnation des océans et l’arrêt du transport de l’oxygène et des nutriments.
La plupart des animaux marins meurent et tombent au fond des océans. Ils se décomposent en dégageant des volumes importants d’hydrogène sulfuré qui viennent empoisonner l’atmosphère terrestre et les animaux terrestres. C’est ce que l’on nomme l’extinction du Permien. L’explication mettant en jeu le sulfure d’hydrogène reste une hypothèse, mais elle devrait séduire plus d’un réalisateur de films catastrophes surfant sur le changement climatique…
Dans l’industrie, le sulfure d’hydrogène peut être un polluant occasionnel, notamment dans l’industrie de la pâte à papier. Il est aussi un intermédiaire pour la production de soufre dans la fabrication de l’acide sulfurique (cf. Acide sulfurique), la précipitation des sulfures des métaux pour l’enrichissement des ressources minières. Il est aussi disponible commercialement sous forme liquide (il se liquéfie au-dessous de -60 °C), avec toutes les précautions nécessaires à sa manipulation.
Le sulfure d’hydrogène et les « algues vertes ».

Une croûte s’était développée en surface, imperméable aux gaz, et sous cette croûte, les bactérie anaérobies décomposaient le milieu organique en réduisant les sulfates de l’eau de mer en sulfures et hydrogène sulfuré. Il suffisait de marcher dans cet amoncellement pour laisser échapper ce gaz qui, à des teneurs supérieurs à 700 ppm, est mortel en quelques minutes.
Pensée du jour
« Entre les gargotes aux œufs pourris et les algues vertes, choisissez bien vos lieux de vacances en juillet. »
Sources
– http://fr.wikipedia.org/wiki/Sulfure_d’hydrogène
– www.inrs.fr/htm/sulfure_d_hydrogene.html
– http://scienceamusante.net/wiki/index.php?title=Sulfure_d’hydrogène
– http://encyclopedia.airliquide.com/encyclopedia.asp?GasID=59&LanguageID=2&CountryID=19
– http://en.wikipedia.org/wiki/Hydrogen_sulfide
– www.sb-roscoff.fr/INVENTAIRES/InvAlgues/index.algues.php?action=fiche_algue&id_algue=501
– www.futura-sciences.com/fr/news/t/developpement-durable-1/d/le-probleme-nauseabond-des-algues-vertes_21247/
Pour en savoir plus
– Monoxyde de carbone
– Méthane
– Plâtre
– Acide sulfurique

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie