Le rofécoxib (Vioxx®) est un anti-inflammatoire non-stéroïdien (AINS, comme l’est l’ibuprofène), d’une nouvelle famille, les coxibs. Comme les autres AINS, les coxibs s’opposent à la formation des prostaglandines, produites par un complexe d’enzymes, les cyclooxygénases ou Cox à partir de l’acide arachidonique, dans de multiples circonstances : douleur, inflammation, fièvre, activité des plaquettes sanguines…
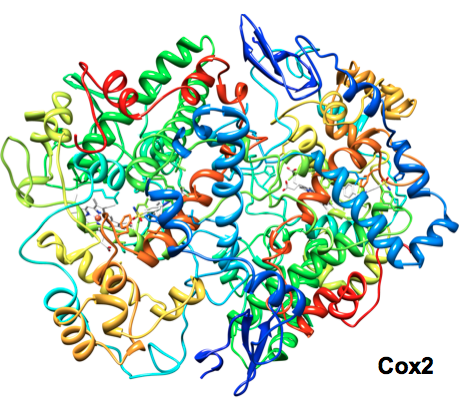
On sait maintenant qu’il existe 3 types de Cox, les principales étant les Cox 1 et 2. La Cox1, découverte en 1976, est constitutive et elle est à l’origine des fonctions protectrices et régulatrices de l’organisme. La Cox2, découverte seulement en 1991, est essentiellement inductive, c’est-à-dire qu’elle n’intervient que lorsqu’il y a inflammation et ne produit que des prostaglandines dites pro-inflammatoires. Les inhibiteurs spécifiques de la Cox2, les coxibs, réduisent ainsi considérablement les risques liés à la diminution des prostaglandines physiologiques. En théorie, les coxibs seraient donc moins nocifs pour la muqueuse digestive que les autres AINS, qui agissent sur la formation de tous les types de prostaglandines.
La recherche d’anti-inflammatoires anti-douleurs est un défi que le succès des AINS présents sur le marché encourage. La découverte de la Cox2 et de ses propriétés relance cette recherche vers des inhibiteurs spécifiques de l’enzyme. Les Cox 1 et 2 possèdent des séquences d’acides aminés relativement proches. Leurs structures 3D sont peu différentes, mais le remplacement d’une seule isoleucine par une valine induit la formation d’une poche latérale, offrant aux coxibs, plus volumineux que les classiques AINS, une accessibilité spécifique.
L’annonce, savamment orchestrée, notamment des fuites dans la presse grand public de l’apparition d’une nouvelle molécule, sans toxicité gastrique ou rénale, avant même que la FDA accorde son AMM, crée une vive émotion chez les patients souffrant d’arthrose, dans le milieu médical… et à Wall Street. D’ailleurs, l’AMM du Vioxx® sera délivrée en 6 mois (contre 15 d’ordinaire), en mai 1999.
Dès 1999, un scientifique de la FDA s’inquiète du nombre d’accidents thromboemboliques, d’attaques cardiaques et d’infarctus que présentent les patients traités au Vioxx®. Une étude, VIGOR (Vioxx Gastro Intestinal Outcome Research), est lancée en 2000, afin de comparer sur 7 000 malades la tolérance intestinale du coxib et celle d’un AINS utilisé de longue date, le Naxoprène : le risque d’accident digestif grave est de 0,59 % pour le premier et de 1,34 % pour le second (et 0,44 % pour le Celebrex®, un autre coxib, objet de l’étude CLASS). Mais ces études rapportaient en outre des taux d’infarctus du myocarde significatifs : 0,74 % pour le Vioxx®, 0,33 % pour le Celebrex®, contre 0,15 % pour le Naxoprène.
Le laboratoire Merck en conclut que le Naxoprène a un effet cardioprotecteur non observé précédemment ! Il est vrai que cette même année 2000, Merck consacre 160 millions $ pour des publicités télévisuelles, puis entre 50 et 100 millions durant les 4 années suivantes, c’est-à-dire jusqu’au retrait, imposé en catastrophe, du médicament.
Le marché français, comme celui des 80 pays où le Vioxx® sera distribué, est investi sans publicité directe (interdite en France), mais porté par une opinion publique convaincue du miracle. Il sera vendu plus de 40 € la boîte de 28 comprimés, prix imposé par la société pharmaceutique avant même la délivrance de l’AMM : il sera, en 2003, le dixième médicament le plus remboursé. Et pourtant la revue Prescrire écrit, dès juillet 2000, que le Vioxx® est « un antalgique anti-inflammatoire non stéroïdien décevant, qu’il n’apporte rien de nouveau, que ses essais cliniques sont imprécis, qu’il reste des questions sans réponses, notamment sur ses effets cardiaques ».
On s’apercevra, à l’expérience, que les inhibiteurs de Cox2 diminuent le taux de prostaglandines en faveur d’une augmentation de thromboxanes, ce qui déséquilibre la balance « fluidité sanguine – coagulation » en faveur de la coagulation, à l’origine des thrombus qui pourraient provoquer des infarctus cardiaques.
Élargir le domaine de prescription aurait permis d’élargir encore un marché annuel de 2,55 milliards $. Une nouvelle indication est donc proposée, à l’instar de celle du Celebrex® concurrent, la prévention de la dégénérescence des polypes du colon, c’est-à-dire du cancer colorectal. Une étude est lancée, portant sur plus de 2 000 malades. Elle sera arrêtée lorsque 2,3 % des patients présenteront, au bout de quelques mois, des complications cardiovasculaires graves (risque de moins de 1 % avec un placebo).
En septembre 2004, le Vioxx®, qui venait d’obtenir une AMM pour la prescription aux enfants de plus de 2 ans, est retiré du marché. On apprendra qu’une étude menée durant l’été 2004 avait conclu qu’il était responsable d’au moins 38 000 attaques cardiaques et morts subites, et plus probablement de 88 000 à 139 000 victimes avec une mortalité de 30 à 40%, rien qu’aux États-Unis. Et cela, sans préjuger d’éventuels effets à moyen-long terme.
En 2007, et plus de 100 000 morts semble-t-il, Merck signera un accord amiable réglant l’essentiel des 26 600 plaintes déposées à son encontre pour un montant de 4,85 milliards $. En 2010, ce sont les actionnaires de la société qui seront autorisés, par la Cour suprême des États-Unis, à la poursuivre pour fraude (dissimulation d’informations) dans l’affaire du Vioxx®.
Des victimes se sont pourvues en justice dans de très nombreux pays. Officiellement, le Vioxx® n’aurait fait aucune victime en France, ce qui est statistiquement surprenant avec environ 500 000 utilisateurs. Le vice-président de l’Assemblée nationale française, président du groupe d’étude sur le médicament et les produits de santé, Yves Bur, explique, dans une interview à l’Expansion, « Merck a suscité l’attente, créé le besoin et fait passer des médecins qui refusaient d’en prescrire pour des ringards ». Après plusieurs refus depuis 2001, le dernier argumenté par la Haute autorité de santé en avril 2009, l’étoricoxib sera finalement commercialisé en France en mars 2010 sous le nom d’Arcoxia® (comme dans 60 autres pays, mais pas aux États-Unis), avec une pharmacovigilance renforcée.
Pensée du jour
« Sept ans sans réflexion : après le Vioxx, le Médiator … »
Sources
– http://fr.wikipedia.org/wiki/Rofécoxib
– http://en.wikipedia.org/wiki/Rofecoxib
– www.medscape.com/viewarticle/733075_2
– http://fr.wikipedia.org/wiki/cyclo_oxygenase
– http://en.wikipedia.org/wiki/Cyclooxygenase
– http://en.wikipedia.org/wiki/COX-2
– www.acmts.ca/fr/media-centre/2004/cox-2-selective-nsaids-not-always-easier-on-your-stomach
– Xie WL, Chipman JG, Robertson DL, Erikson RL, Simmons DL (April 1991), PNAS 88 (7): 2692–6
– http://lexpansion.lexpress.fr/economie/les-dessous-d-un-megaratage-pharmaceutique_23087.html
– http://en.wikipedia.org/wiki/Celebrex
– www.has-sante.fr/portail/jcms/c_825456/arcoxia-120-mg-etoricoxib-ains
– www.lemonde.fr/societe/article/2011/01/10/l-antidouleur-arcoxia-n-aurait-jamais-du-etre-autorise-et-rembourse_1462495_3224.html

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie