Les acétates sont les produits de réaction entre l’acide acétique (cf. Acide acétique), une base, un métal ou un composé organique renfermant une fonction alcool. De formule générale Mm(CH3COO)n, où m et n varient en fonction de la valence du métal, les acétates hybrides les plus courants sont les acétates alcalins M(CH3COO).
L’exemple usuel est la produit issu de la réaction avec la soude ou la potasse : NaOH + CH3COOH ———> CH3COONa + H2O
L’acide acétique, bien qu’acide faible peut aussi attaquer directement les métaux, comme le cuivre :
2 Cu + 4 CH3COOH ———> Cu2(CH3COO)3 + 2 Hr />4
3CO)2O), générateurs de l’ion acylium, [CH3CO]+.
Les acétates organiques sont nombreux : on peut citer l’acétate d’éthyle, employé comme solvant et l’acétate d’isoamyle (acétate de 3-méthylbutyle), également employé comme solvant, mais aussi présent dans des fruits tels que la pomme mûre et la banane. Dans la fermentation alcoolique d’un moût rosé ou lors de la macération carbonique il est possible d’obtenir une production naturelle d’acétate d’isoamyle, ce qui fut constaté il y a une vingtaine d’année dans le Beaujolais… bien avant le changement climatique !
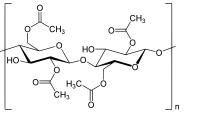
L’acétate de cellulose (cf. Cellulose) -il faudrait d’ailleurs dire les acétates de cellulose, car à coté de l’acétate existent le diacétate, le triacétate et le tétra et pentaacétate- est produit en très gros tonnages. Ses fibres tissées donnent des tissus comme la rayonne ou la viscose. L’acétate de cellulose a été découvert en 1865 à Mulhouse par Paul Schützenberger (cf. Paul Schützenberger) par action de l’anhydride acétique sur la cellulose.
Sa fabrication industrielle a été mise au point par les frères Camille et Henri Dreyfus (très appréciés de jeunes professeurs américains…) dans un hangar situé à Bâle et commercialisé par eux dès 1905. D’abord utilisé comme vernis puis comme film, le triacétate est soluble dans l’acétone, on peut donc l’utiliser comme vernis ou enduits pour tissus, l’isolation de fils électriques. L’entoilage des avions au début du XXe siècle, où la France fut leader jusqu’en 1914, en est un exemple d’application. Dès 1924 on put aussi le filer et obtenir les premières fibres artificielles inventées par les chimistes et aussi polymère naturel car la cellulose était extraite des plantes et végétaux. Les tissus produits sous le nom de rayonne ou de viscose, dits « soie artificielle », eurent beaucoup de succès jusque dans les années 1950, où les fibres issues de la pétrochimie comme le polyester et le nylon, moins coûteuses à fabriquer, les ont concurrencés durablement.
Dès 1935, le triacétate fut aussi utilisé pour les pellicules photographiques afin de remplacer le nitrate de cellulose, instable et inflammable. Des dizaine de milliers de films ont été réalisés avec ce type de support, qui, avec le temps, vieillissent mal, car en présence de chaleur et d’humidité, la pellicule laisse échapper de l’acide acétique (« syndrome du vinaigre »), d’où de grandes précautions (climatisation, atmosphère sèche) pour conserver les archives cinématographiques de l’INA. L’utilisation actuelle est majoritairement celle des « cordes d’acétates » qui servent comme filtres de cigarettes et aussi comme réservoir d’encre pour les stylos.
L’acétate de cuivre de formule brute Cu2(CH3COO)4, ou acétate cuivrique, est un solide vert foncé, sa forme hydratée Cu2(CH3COO)4,2H2O est de couleur bleue. C’est un fongicide et un colorant. Sa production a été autrefois concentrée dans les zones vinicoles, puisque par fermentation du moût de raisin à l’air on obtient l’acide acétique (vinaigre) que l’on faisait réagir sur le cuivre.
C’est aussi le principal constituant du vert-de-gris qui se produit par vieillissement à l’air de fils ou plaques de cuivre. La composition moyenne du vert-de-gris est Cu(CH3COO) Cu(OH)2,5H2O, les proportions d’hydrate et d’eau sont variables, mais le cuivre est présent à la fois sous forme mono- et divalente.
L’acétate de potassium, CH3COOK, est utilisé dans la fabrication de colorants textiles. C’est aussi un additif alimentaire classé comme conservateur et correcteur de pH (E261). En solution aqueuse, il peut être utilisé comme extincteur pour les incendies domestiques. En effet, au contact de substances chaudes (huile brûlante) il forme une mousse qui étouffe les flammes. Il se nettoie facilement et il n’est pas toxique. Dans certains aéroports, comme celui de Montréal, malgré son prix, il est utilisé contre le verglas comme sel « déglaçant », car moins corrosif que le chlorure de sodium.
L’acétate de sodium, CH3COONa est une poudre cristalline blanche assez hygroscopique. Il se prépare par réaction de la soude avec l’acide acétique, c’est aussi un sous-produit de la saponification des acétates d’alkyles (cf. Glycérol, Savon). Très soluble dans l’eau, il peut être utilisé pour des expériences simples de solutions sursaturées. On l’utilise aussi en médecine sous forme d’acétate de sodium injectable USP, solution concentrée stérile qu’il faut diluer pour la perfusion veineuse comme ajout électrolytique apport de sodium pour le patient.
Dans les grandes surfaces spécialisées dans le sport sont vendues de poches qui contiennent ces solutions, avec une plaquette à l’intérieur qu’on agite pour provoquer l’apparition de germes, puis la cristallisation et une augmentation de température qui peut subsister quelque heures et réchauffer l’alpiniste ou l’explorateur polaire en conditions extrêmes.
Le coin du petit chimiste : la Glace Chaude
On dissout de l’acétate de sodium dans de l’eau frémissante jusqu’à saturation en mélangeant constamment. Lorsque tout l’acétate est dissous, verser la solution dans un récipient transparent (verre ou plastique), s’assurer qu’il n’y a plus de petits cristaux. Quand la solution est refroidie (on peut la mettre au réfrigérateur), touchez-la avec un doigt : tout se solidifie en quelques secondes et devient chaud : vous avez de la glace chaude !
Sources
– http://fr.wikipedia.org/wiki/Acétate
– http://fr.wikipedia.org/wiki/ Acétate _de_cellulose
– http://fr.wikipedia.org/wiki/ Acétate _d’éthyle
– http://fr.wikipedia.org/wiki/ Acétate _de_sodium
– http://fr.wikipedia.org/wiki/ Acétate _de_cuivre
– http://fr.wikipedia.org/wiki/ Acétate _de_potassium
– http://fr.wikipedia.org/wiki/ Acétate _d’isoamyle
– http://en.wikipedia.org/wiki/Acetate
Pour en savoir plus
– Acide acétique
– Cellulose
– Paul Schützenberger
– Glycérol
– Savon

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie