De formule brute C2H4O2, on représente le plus souvent l’acide acétique par les formules CH3COOH ou CH3CO2H afin de mieux traduire sa structure. Toutefois, l’abréviation la plus courante est AcOH, où Ac représente le groupement acétyle CH3CO. C’est un acide faible (p Ka 4,75) ; l’ion résultant de la perte du proton H+ porte le nom d’acétate, AcO– qui fait également référence à un sel contenant cet anion ou à un ester de l’acide acétique.
L’usage de l’acide acétique en chimie remonte à l’Antiquité. En fait, toute culture pratiquant le brassage de la bière ou la vinification du moût de raisin a inévitablement découvert le vinaigre, résultat naturel de l’évolution de ces boissons alcoolisées laissées à l’air libre. L’emploi du vinaigre intervenait dans la fabrication de pigments (plomb blanc, vert-de-gris), mais également dans la préparation d’un sirop sucré riche en acétate de plomb, le sapa, qui contribua en partie à la chute de l’Empire romain…
Au VIIIe siècle, l’alchimiste perse Jabir Ibn Hayyan, un des fondateurs de l’alchimie, concentra l’acide acétique à partir du vinaigre par distillation. Durant la Renaissance, l’acide acétique pur (dit « glacial » parce qu’il formait des cristaux ressemblant à la glace…) était préparé par distillation sèche d’acétates métalliques. Au XVIe siècle, l’alchimiste allemand Andreas Libavius compara l’acide pur ainsi produit au vinaigre.
La présence d’eau dans le vinaigre a tant d’influence sur les propriétés de l’acide acétique que pendant des siècles de nombreux chimistes ont cru qu’il s’agissait de deux substances différentes. C’est le chimiste français Pierre Auguste Adet qui prouva qu’ils étaient le même composé
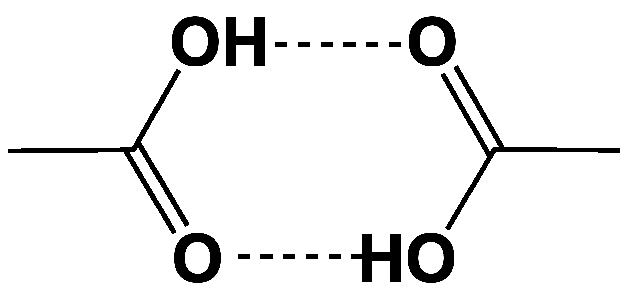
La structure cristalline de l’acide acétique montre que les molécules s’associent par deux en dimères connectés par des liaisons hydrogène (cf. Eau). Ces dimères sont probablement aussi présents dans la phase liquide de l’acide acétique pur, mais sont rapidement rompus à la moindre présence d’eau qui est un meilleur donneur que l’acide acétique pour la formation de ces liaisons
L’acide acétique est produit de façon synthétique ou par fermentation bactérienne. Aujourd’hui, la méthode biologique ne concerne plus que 10% de la production, mais elle demeure importante pour la fabrication de vinaigre car, dans la plupart des pays, la législation prescrit que le vinaigre à usage alimentaire doit être d’origine biologique. L’importance industrielle de cet acide (la production mondiale est de l’ordre de 7 Mt/an) demandait des procédés efficaces, liés à la pétrochimie. L’oxydation directe du butane en présence d’ions métalliques (chrome, manganèse, cobalt) :
2 C4H10 + 5 O2 → 4 CH3COOH + 2 H2O
s’accompagne de la formation d’autres acides carboxyliques dont la séparation est économiquement coûteuse. Dans les années 60 à 70, des procédés {sélectifs ont vu le jour, montrant que l’industrie chimique faisait dans le durable sans le dire, mais pas sans le savoir…
Le premier procédé multi-étapes constituait en l’oxydation de l’éthylène en éthanal, CH3CHO, suivie de son oxydation en acide acétique. L’étape clef correspond au procédé Wacker employant la catalyse par complexes de coordination, en l’occurrence le tétrachloropalladate de sodium, Na2PdCl4 en milieu aqueux acide, associé au chlorure cuivrique que l’on peut résumer par les trois réactions :
[PdCl4]2− + C2H4 + H2O → CH3CHO + Pd + 2 HCl + 2 Cl−
Pd + 2 CuCl2 + 2 Cl− → [PdCl4]2− + 2 CuCl
2 CuCl + 0,5 O2 + 2 HCl → 2 CuCl2 + H2O
La première réaction représente l’oxydation proprement dite de l’éthylène ; la seconde réaction conduit à la régénération du sel de palladium qui favorise la formation de l’éthanal selon un processus multi-étapes qui a fait l’objet d’un nombre impressionnant d’études ; la troisième réaction décrit la réoxydation du sel cuivreux en sel cuivrique au contact du dioxygène de l’air.
Si ce procédé, sous différentes variantes, est toujours employé, environ 75 % de l’acide acétique destiné à l’industrie chimique est produit par carbonylation du méthanol (cf. Méthanol et Monoxyde de carbone) selon les procédés catalytiques BASF, Monsanto puis Cativa de la British Petroleum. Cette réaction :
CH3OH + CO → CH3COOH
est l’archétype de la « réaction idéale » où deux molécules s’unissent pour fournir spécifiquement le produit visé. Elle comporte trois étapes, schématisées par :
CH3OH + HI → CH3I + H2O
CH3I + CO → CH3COI
CH3COI + H2O → CH3COOH + HI
C’est la seconde réaction qui emploie encore des composés de métaux de transition : cobalt dans le cas du procédé BASF, maintenant abandonné, rhodium dans le cas du procédé Monsanto, iridium associé au ruthénium dans le cas du procédé Cativa. Ces réactions sont extrêmement corrosives : les mélanges de monoxyde de carbone, eau et acide iodhydrique attaquaient pratiquement tous les aciers connus. Monsanto a dû engager deux métallurgistes pour mettre au point une nuance de superalliage Hastelloy.
L’acide acétique est un intermédiaire de la synthèse de nombreux composés. L’acétate de vinyle, produit de la réaction de l’acide acétique et de l’éthylène selon une variante du procédé Wacker, représente 40-45 % de la production mondiale. Il est employé pour la fabrication de peinture et adhésifs. L’anhydride acétique (25-30 % de la consommation mondiale) résultant d’une réaction de déshydratation en cétène, puis condensation avec une molécule d’acide acétique, est un agent d’acylation, notamment pour la préparation de l’acétate de cellulose très utilisé dans les pays asiatiques pour les filtres de cigarettes. Enfin, 15 à 20 % de la production mondiale est employé comme solvant (par exemple en synthèse de l’acide téréphtalique, point de départ du PET, cf. Ethylène glycol) ou précurseur de solvants organiques.
Le groupe acétyle, dérivé de l’acide acétique, est fondamental pour la biochimie de quasiment toutes les formes de vie. Lorsqu’il est lié au coenzyme A, il a une importance centrale dans le métabolisme des glucides et des lipides.
Pensée du jour
«Du filtre pour cigarette à l’acétylcoenzyme A, l’acide acétique n’est pas un pisse-vinaigre.»
Sources
– http://fr.wikipedia.org/wiki/Acide_acétique
– http://en.wikipedia.org/wiki/Acetic_acid
– www.inrs.fr/htm/acide_acetique.html
– http://fr.wikipedia.org/wiki/Jabir_Ibn_Hayyan
– http://en.wikipedia.org/wiki/Wacker_process
– http://en.wikipedia.org/wiki/Wacker_process
– http://en.wikipedia.org/wiki/Cativa_process
– http://en.wikipedia.org/wiki/Hastelloy
– http://fr.wikipedia.org/wiki/Acétate_de_cellulose
– http://fr.wikipedia.org/wiki/Vinaigre
Pour en savoir plus
– Eau
– Méthanol
– Monoxyde de carbone
– Ethylène glycol

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie