Le benzène a été découvert en 1825 par Michael Faraday qui l’isola de distillats de houille et le baptisa Bicarburet of hydrogen. En 1833, le chimiste allemand Eilhard Mitscherlich le produisit par distillation en présence de chaux de l’acide benzoïque, composant du benjoin. De ce fait, il baptisa ce composé Benzin. En 1845, le chimiste anglais Charles Mansfield, travaillant sous la direction d’August Wilhelm von Hofmann, l’isola du goudron de houille. Quatre ans plus tard, il lançait la première production à l’échelle industrielle. En 1868, Marcellin Berthelot le synthétise par cyclotrimérisation de l’acétylène.
Jamais structure de molécule apparemment aussi simple que C6H6n’a autant concerné la communauté scientifique dès le milieu du XIXe siècle, en plein développement de la chimie organique. Plusieurs structures furent proposées sans parvenir à expliquer les propriétés chimiques du composé, notamment l’existence de trois isomères pour les dérivés disubstitués. Parmi celles-ci, on peut citer le « benzène de Dewar », le prismane (Albert Ladenburg), le benzvalène, le « benzène de Claus », le « benzène d’Armstrong ». Les trois premières structures ont été préparées dans la seconde moitié du siècle dernier.
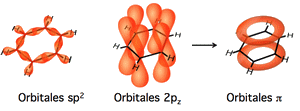
La première structure correcte fut proposée en 1861 par le physico-chimiste autrichien Johann Josef Loschmidt. En 1865, le chimiste allemand Friedrich August Kekulé publia en français (il enseignait alors en Belgique…) la structure hexagonale comportant alternativement des liaisons simples et doubles entre les atomes de carbone. Kekulé mit en évidence le fait que les deux représentations de cette molécule sont équivalentes, proposition reprise par la suite par Johannes Thiele avec son concept de « valence partielle ». La nature cyclique et plane du benzène avec des liaisons carbone-carbone identiques (140 pm) a été démontrée par la structure cristallographique établie en 1929 par Kathleen Lonsdale.
Le benzène est produit lorsque des composés riches en carbone subissent une combustion incomplète. Il est ainsi produit par les volcans ou les incendies de forêt, mais aussi présent dans la fumée de cigarette. Actuellement, la majeure partie du benzène provient de l’industrie pétrochimique, avec une part mineure issue du charbon. En Europe, cette production est principalement issue de trois procédés : le vapocraquage (60 %) le reformage catalytique (25 %), l’hydrodésalkylation du toluène (12 %), auxquels s’ajoute la carbochimie (6 %). En 2008, la production mondiale de benzène avoisinait 42 Mt.
– le vapocraquage (cf. Éthylène) permet d’obtenir une plus grande proportion de composés aromatiques à partir de charges moyennes ou lourdes (naphta ou gazole) qui contiennent déjà des hydrocarbures à 6, 7 ou 8 atomes de carbone.
– le reformage catalytique consiste à synthétiser des composés aromatiques par déshydrogénation des cyclohexanes, des alcanes et déshydroisomérisation des cyclopentanes.
La réaction est catalysée par un composé multifonctionnel accélérant la déshydrogénation, la cyclisation et l’isomérisation. Un catalyseur à base de platine ou de rhénium sur un support d’alumine activée par des chlorures ou des fluorures est employé, mais nécessite des charges purifiées pour éviter la désactivation du catalyseur.
– l’hydrodésalkylation du toluène convertit le toluène en benzène. Dans ce procédé, un mélange toluène-dihydrogène passe sur un catalyseur (oxyde de chrome, de molybdène ou de platine) à une température comprise entre 500 et 600°C et une pression comprise entre 40 et 60 bar.
C6H5CH3 + H2 ———> C6H6 + CH4
Le benzène est utilisé en majeure partie comme intermédiaire dans la synthèse d’autres composés chimiques. Les dérivés du benzène produits dans les plus grandes quantités sont l’éthylbenzène, précurseur du styrène, utilisé pour fabriquer différents types de polymères (cf. Butadiène), le phénol, utilisé pour fabriquer des résines et des adhésifs (cf. {Méthanal), et le cyclohexane, utilisé pour fabriquer le nylon. (cf. Nylon). Des quantités moins importantes de benzène sont utilisées dans la fabrication de pneus (cf. Caoutchouc), de lubrifiants, de colorants, de détergents, de médicaments, d’explosifs ou de pesticides.
Le benzène a fait son retour dans de nombreux pays à la suite des réglementations concernant la teneur en plomb de l’essence (cf. Plomb tétraéthyle). Aux États-Unis, les préoccupations concernant ses effets nocifs sur la santé et la possibilité de contamination des nappes phréatiques ont conduit à la mise en place d’une réglementation stricte concernant la teneur en benzène des carburants avec une limite voisine de 1 %. En Europe, cette même limite a été fixée.
Le benzène est un solvant inflammable et toxique. Il a été classé cancérogène par l’Union européenne. Son usage est donc strictement réglementé. En France, il est interdit de commercialiser des solvants contenant plus de 0,1 % de benzène. L’inhalation d’un taux très élevé de benzène peut causer la mort ; des taux moins élevés peuvent occasionner des somnolences, des vertiges, une accélération du rythme cardiaque, des maux de tête, des tremblements, la confusion ou la perte de connaissance. La dose létale par ingestion est de 50 mg/kg. En France métropolitaine, le principal secteur émetteur de benzène dans l’atmosphère est le résidentiel/tertiaire (75,8 % des émissions totales en 2007), en particulier du fait de la combustion du bois, suivi du transport routier (14,1 % en 2007).
Pensée du jour
« Benzène, Benzine, Benzol, Benzyle : que de déclinaisons industrielles ! »
Sources
– http://fr.wikipedia.org/wiki/Benzène
– http://culturesciences.chimie.ens.fr/dossiers-chimie-histoire-article-Histoire_Benzene_Baudin_1.html
– www.faidherbe.org/site/cours/dupuis/aromatiq.htm
– http://en.wikipedia.org/wiki/Benzene
– www.societechimiquedefrance.fr/extras/Donnees/orga/benzene/cadbenz.htm
– www.petrochemistry.net/benzene-production-consumption-and-trade-balance.html
Pour en savoir plus
– Éthylène
– Butadiène
– Méthanal
– Nylon
– Caoutchouc
– Plomb tétraéthyle

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie 

