C’est (encore) Carl Wilhem Scheele qui, en 1778, identifie le molybdène en le séparant du plomb et isole l’oxyde MoO3 et la molybdénite, MoS2. Quatre ans plus tard, Peter Jacob Hjelm obtient le métal impur par réduction de l’oxyde par le carbone, mais ce n’est qu’en 1894 qu’Henri Moissan l’obtient pur au cours de ses recherches sur les hautes températures. Les minerais naturels sont la wulfénite (PbMoO4) et la powelite (CaMoO4), mais les sources principales sont les porphyres à molybdène où il est présent sous forme de molybdénite, MoS2, où le sulfure gris argenté se présente sous forme d’agrégats de plaquettes hexagonales. Ces porphyres contiennent, à coté de la silice, une bonne teneur en cuivre (cf. Cuivre) ce qui fait que le molybdène est souvent un sous-produit de l’extraction du cuivre.. Les principaux producteurs sont les États-Unis, la Chine et le Chili.
Le molybdène est obtenu en deux étapes à partir de la molybdénite. La première étape consiste en le grillage (700 °C) à l’air du sulfure MoS2 qui conduit à l’oxyde de molybdène(VI) :
2 MoS2 + 7 O2 ———> 2 MoO3 + 4 SO2
La sublimation de l’oxyde à 1 100 °C conduit à un produit exempt de cuivre qui est soit réduit par le dihydrogène pour conduire au métal, soit par aluminothermie (cf. Aluminium) en présence de fer pour conduire au ferromolybdène employé pour l’élaboration d’alliages.
Jusqu’en 1900 le molybdène restait une curiosité de laboratoire, mais lorsque les aciéristes s’employèrent à faire des aciers pour blindage, notamment lors de la Première Guerre mondiale, ils utilisèrent le molybdène pour leur conférer plus de dureté. De quelques milliers de tonnes, la production dépassait 100 kt dans les années 90 et 200 kt en 2010, la Chine en fournissant et consommant actuellement 77 kt. La demande croissante d’aciers spéciaux se répercute sur les prix, de l’ordre de 20 à 40 $ le kg selon crise ou surchauffe économique. Cette demande s’explique par les propriétés du molybdène : c’est un métal dur, offrant une bonne résistance mécanique ainsi qu’à la corrosion. Son haut point de fusion, 2 620 °C, en fait un métal très utilisé pour les traitements haute température et pour les aciers réfractaires. Son prix et la demande en font actuellement un matériau stratégique.
L’utilisation première, pour environ la moitié de la production annuelle, est l’élaboration d’alliages. L’addition de molybdène durcit l’acier en améliorant sa résistance et son ouvrabilité. Les alliages spéciaux comme les Hastelloy® sont très résistants et peu corrodés à haute température. D’autres aciers utilisés en milieu marin, l’alliage magnétique Permalloy, en contiennent des valeurs comprises entre 2 et 4 %. Comme le tungstène, le molybdène est utilisé comme cathode dans les tubes à rayons X avec une raie Kα de longueur d’onde moyenne 0,070926 nm.
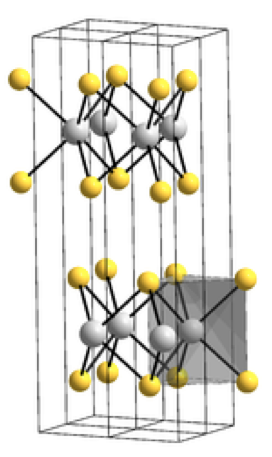
Le sulfure de molybdène est employé comme lubrifiant mécanique résistant à haute température. Il présente une structure cristalline intéressante, chaque ion Mo étant lié à six ions sulfure dans un prisme droit triangulaire, ce qui fait que chaque couche de molybdène alterne avec deux couches de soufre adjacentes qui développent des forces faibles de Van der Waals et qui peuvent donc glisser facilement, à l’origine de cet emploi.
Il est stable à l’air, mais s’oxyde à haute température selon la réaction :
2 MoS2 + 7 O2 ———> 2 MoO3 + 4 SO2
La structure lamellaire du sulfure de molybdène lui permet d’accueillir des atomes alcalins par intercalation pour donner des structures de type LixMoS2

La durée de vie entre 1 000 ° et 1 650 °C excède 18 mois. Les résistors sont fabriqués par frittage sous pression à 1600 °C. À l’air, et à haute température, les barres de MoSi2 se recouvrent d’une pellicule de silice SiO2 protectrice, évitant ainsi l’oxydation à cœur.
En catalyse chimique, le sulfure de molybdène, associé au sulfure de cobalt (cf. Cobalt) ou de nickel (cf. Nickel), est employé en catalyse d’hydrocraquage des composants soufrés ou azotés contenus dans les distillats de pétrole. Cette catalyse est primordiale pour l’obtention de carburants (essence et diesel) à faibles teneurs en soufre pour éviter l’émission des oxydes de soufre (cf. Soufre), en partie responsable de la pollution atmosphérique et répondre ainsi aux normes européennes.
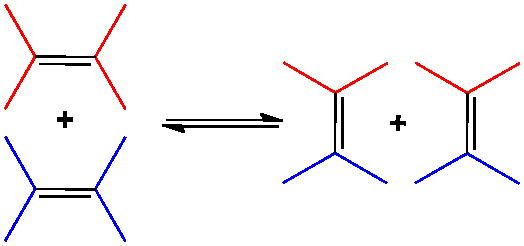
Des catalyseurs à base de molybdène sont à l’origine d’une réaction étonnante : la réaction de métathèse ou, plus précisément d’alkylidénolyse des oléfines, dans laquelle les groupes alkylkidène s’échangent au cours d’un processus pratiquement athermique. Le mécanisme de cette réaction, aux nombreuses applications, fut proposé par Yves Chauvin et lui valut l’attribution du Prix Nobel de Chimie en 2005, qu’il partagea avec Robert H. Grubbs (cf. Ruthénium) et Richard R. Schrock.
Le molybdène est aussi un élément nécessaire à pratiquement tous les organismes où on le retrouve dans une cinquantaine de métalloenzymes dont les plus importantes sont les nitrogénases intervenant dans le processus de conversion du diazote atmosphérique en ion ammonium assimilable par les plantes (cf. Azote) essentiel à la fertilité et la régénération des sols. C’est aussi un oligoélément qui intervient dans la fabrication de certains acides aminés constituants des protéines.
On le trouve dans les légumes, les céréales, la viande de façon analogue au sélénium. Dans l’alimentation, pour 100 g on trouve 90 µg dans le céleri rave, 70 µg dans l’ail, 20 µg dans la papaye. L’apport conseillé pour un adulte est de l’ordre de 30 à 50 µg par jour, l’insuffisance entraîne des troubles neurologiques et rénaux. Toujours dans le domaine biologique, il faut mentionner le rôle de l’isotope 99Mo, isotope parent du technétium-99m employé en imagerie médicale;
Pensée du jour
« Le molybdène est à l’acier ce que le biceps est au bras »
Sources
– http://fr.wikipedia.org/wiki/Molybdène
– http://en.wikipedia.org/wiki/Molybdenum
– http://minerals.usgs.gov/minerals/pubs/commodity/molybdenum/mcs-2011-molyb.pdf
– www.periodicvideos.com/videos/042.htm
– www.techniques-ingenieur.fr/glossaire/hydrodesulfuration
– www.espci.fr/enseignement/download.php?e=cmi&id=60
– www.nobelprize.org/nobel_prizes/chemistry/laureates/2005/chemadv05.pdf
Pour en savoir plus
– Tungstène
– Cuivre
– Aluminium
– Cobalt
– Nickel
– Soufre
– Ruthénium
– Azote

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie