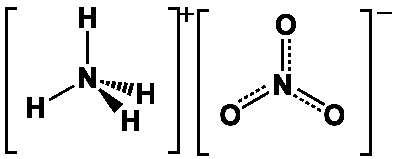
Le nitrate d’ammonium est un sel de l’acide nitrique (cf. Acide nitrique) et de l’ammoniac (cf. Ammoniac) de formule NH4NO3. C’est l’un des plus importants composés azotés. Sa préparation est relativement simple :
NH3 + NO3H ———> NH4NO3
De masse moléculaire M= 80, cristallisé, il a une densité de l’ordre d = 1,72 et son point de fusion F = 169 °C. Cependant le nitrate d’ammonium est instable au dessus de 170 °C et à 300 °C il se décompose de façon parfois explosive en dégageant beaucoup de gaz et de chaleur :
NH4NO3 ———> N2 + 2H2O + 0,5 O2 (V = 981 cm3/g et ΔQ = –1 465 J/g
La dissolution dans l’eau s’accompagne d’une forte absorption de chaleur, qui fait utiliser le nitrate pour des mélanges réfrigérants, la température pouvant atteindre –17 °C, la chaleur de dissolution est évaluée à 26 000 J/M.
C’est un solide qui cristallise sous plusieurs formes allotropique. Orthorhombique à température ordinaire il devient quadratique au dessus de 32 °C puis cubique au-delà de 120 °C. La transition structurale à 32°C s’accompagne d’une forte variation de volume de 3 % qui casse la maille et forme des macles en fragilisant les grains qui peuvent tomber en poussière.
– C’est aussi un sel très hygroscopique : à 18°C on peut en solubiliser 180 g dans 100 g d’eau. Il est aussi soluble dans l’ammoniac anhydre sous pression.
– La fabrication s’opère suivant différents procédés qui ont cependant en commun :
– la neutralisation de l’acide nitrique,
– la concentration des solutions nitriques,
– la granulation du nitrate cristallisé.

D’autres procédés utilisent le nitrate fondu dans un granulateur tournant pour obtenir une granulométrie moyenne de 3 mm, plus commerciale. Pour stabiliser le grain on ajoute divers sels : sulfate de calcium, nitrate de magnésium, sulfate d’aluminium et, pour éviter la prise en masse (mottage), les grains sont enrobés avec un tensioactif comme une alkylamine, ou de cire.
Le procédé BASF se distingue en utilisant un sous-produit de la fabrication des engrais phosphatés, le nitrate de calcium suivant la réaction :
Ca(NO3)2,4 H2O + 2 NH3 + CO2 ———> 2 NH4NO3 + CaCO3 + 3 H2O
Le nitrate d’ammonium est un oxydant puissant. Le nitrate fondu oxyde les métaux comme le zinc et le plomb qui se dissolvent sous son action. Des impuretés métalliques comme le cuivre accélèrent sa décomposition. Le nitrate d’ammonium se vaporise partiellement avant fusion et il se décompose à 185 °C :
NH4NO3 ———> N2O + H2O
La réaction est légèrement différente lorsqu’il détone :
NH4NO3 ———> 2N2 + 4H2O + O2
Les dérivés chlorés tels que NH4Cl accélèrent sa décomposition. La réaction explosive a été étudiée par Marcellin Berthelot en 1870 lors du siège de la ville de Paris (cf. Marcellin Berthelot). Elle développe 1 500 kj/kg ; insensible aux chocs et aux frottements, le nitrate d’ammonium est un explosif « médiocre » sauf s’il est mélangé à des combustibles comme des hydrocarbures, ou s’il est fondu et confiné lors, par exemple, d’un incendie violent. Ce qui peut parfois poser problème, c’est la formule des tensioactifs et anti-mottants comme le dodécylsulfate de sodium (cf. [{Persil & Lessives->472]) associé à des huiles minérales ou à la cire qui, à l’évidence, constituent des matières organiques combustibles.

La consommation en France est de l’ordre de 1 Mt/an et le prix avoisine 200 € la tonne.
En tant qu’explosif, mélangé au TNT (trinitrotoluène) ou à la pentrite il est utilisés dans le bâtiment, les mines et les carrières. Dans l’ANFO (Ammonium Nitrate Fuel Oil), composé de 94% de nitrate d’ammonium et de 6% d’huile, il est peu sensible et convient pour les travaux de génie civil, car il a une vitesse de propagation faible de l’ordre de 3 000 m.s-1 comparé à celle de la dynamite, 6 000 m.s-1.
Le nitrate d’ammonium est toxique pour l’homme. Par inhalation de ses poussières, il irrite les voies respiratoires ; par exposition prolongée il provoque des faiblesses, des céphalées et par contact, des irritations de la peau.
Quelques catastrophes provoquées par le nitrate d’ammonium
– 21 septembre 1921, Oppau (Allemagne). Dans l’usine BASF, 4 500 t de nitrate et de sulfate d’ammonium détonent, provoquant la mort de 530 à 590 personnes et des dégâts dans un cercle de 90 km de diamètre. L’explosion a été provoquée par une cartouche de dynamite qui devait créer un front de taille dans le nitrate pris en masse, procédé pourtant couramment employé jusqu’à lors.
– 26 avril 1947, Texas City (États-Unis). Lors de l’incendie d’un cargo français le « SS Grandcamp » qui contenait plusieurs centaines de tonnes de nitrate, pour étouffer l’incendie les écoutilles sont fermées et de la vapeur chaude est envoyée. L’explosion fait 561 morts et 3 000 blessés en ruinant la zone pétrochimique : les experts comparèrent cette explosion à la puissance de la bombe atomique sur Nagasaki.
– 28 juillet 1947, Brest. 3 000 t de nitrate d’ammonium dans un navire norvégien « l’Ocean Liberty » subissent un incendie qui fait couler de la paraffine sur le nitrate fondu d’ammonium. Le cargo en feu est remorqué dans la rade ; il s’échoue sur un banc de sable et explose avant que la Marine ne puisse le couler ; le bilan est de 22 morts et 500 blessés.
– 28 novembre 1988, Kansas City (États-Unis). Explosion sur un chantier avec du nitrate d’ammonium mélangé à de l’essence et des pastilles d’aluminium.
– 13 décembre 1994, Sioux City (États-Unis). Sur le site de fabrication, explosion de 75 t de nitrate dans le réacteur et la réserve voisine ; le bilan est de 4 morts et 18 blessés.
– 21 septembre 2001, Toulouse. Dans l’usine AZF, l’explosion du stockage de 300 à 400 t de nitrate d’ammonium déclassées à cause d’une granulométrie ou composition non conformes se traduit par 30 morts, 2 500 blessés et des dégâts considérables sur plusieurs kilomètres à la ronde.
Ces explosions accidentelles ont conduit à des renforcements de la réglementation du stockage, de l’état de pureté, de la nature des tensioactifs et des protocoles de manipulation, afin de limiter les risques.
Pensée du jour
« Coup de fouet pour les plantes, coup de foudre pour les hommes, le nitrate est versatile. »
Sources
– http://www.ensiacet.fr/
– http://fr.wikipedia.org/wiki/Nitrate_d’ammonium
– http://fr.wikipedia.org/wiki/Ammonitrate
– http://en.wikipedia.org/wiki/Ammonium_nitrate
– www.societechimiquedefrance.fr/extras/Donnees/mine/eng/cadeng.htm
– http://fr.wikipedia.org/
– www.societechimiquedefrance.fr/extras/Guiochon/introbm.htm
– www.societechimiquedefrance.fr/extras/Guiochon/jeucadresGGok.htm
– http://fr.wikipedia.org/wiki/Explosion_de_l’usine_AZF_de_Toulouse
Sources
– Acide nitrique
– Ammoniac
– Acide sulfurique
– Marcellin Berthelot
Pour en savoir plus
– Persil & Lessives

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie