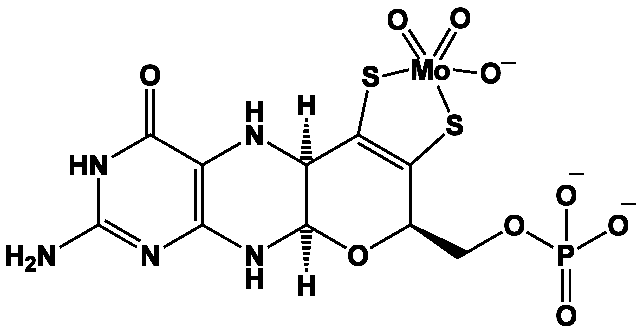
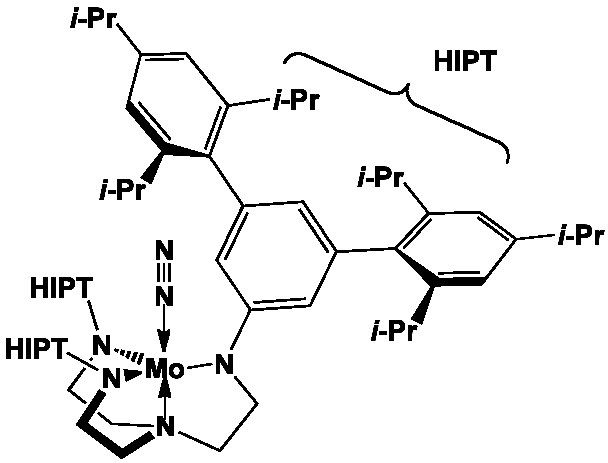
Les bactéries dites diazotrophes fabriquent l’unique enzyme capable de transformer le diazote en ion ammonium assimilable par les plantes, une nitrogénase (cette transformation fournirait environ 108 tonnes par an d’ammoniac !). Elles sont principalement de deux types.
D’une part, les fixateurs libres, comme Azospirillum, Clostridium, Azobacter, etc. attirés et guidés par les messagers chimiques émis par les racines des plantes, forment des kystes, chimiotactisme important dans la régénération des sols en azote, notamment après surexploitation, érosion, désertification…
D’autre part, les fixateurs symbiotiques, comme ceux présents dans les couples Rhizobium-légumineuses (les fabacées), ou Frankia-aulne, casuarina, etc., qui forment des nodules racinaires ou caulinaires, induits par l’infection bactérienne. Chaque plante possède son partenaire bactérien spécifique, et la reconnaissance entre les deux espèces se fait grâce à un signal chimique. Dans un premier temps, des exsudats racinaires contenant des flavonoïdes sont perçus par la bactérie, qui s’infiltre alors au niveau des poils racinaires, puis déclenchent la formation d’hétérocystes protecteurs (du grec heteros, différent, et cystis, sac).
C’est en 1901 que le virologue hollandais Martinus Beijerinck découvrit que certaines plantes pouvaient se nourrir à partir du diazote atmosphérique. En 1930, H. Bortels démontra que le molybdène était impliqué dans la réaction enzymatique. L’énergie nécessaire à l’action des nitrogénases est apportée par l’hydrolyse de 16 équivalents d’ATP :
N2 + 8 e– + 8 H+ + 16 ATP ———> 16 ADP + 16 Pi + 2 NH3 + H2
La relation symbiotique qui s’établit entre une bactérie et une plante hôte permet un échange gagnant-gagnant : la plante produit par photosynthèse l’énergie nécessaire ; en retour, elle est alimentée en éléments azotés nécessaires à sa vie. Les nitrogénases ressemblent structurellement et fonctionnellement à la protochlorophyllide réductase (cf. Chlorophylles), présente dans les bactéries photosynthétiques, mais qui aurait été perdue au cours de l’évolution, ce qui aurait nécessité « l’invention » d’une voie alternative. Le complexe enzymatique qui permet la fixation du diazote est nommé dinitrogénase.
C’est un complexe protéique composé de deux métalloprotéines de taille différente, La protéine la plus petite est une métalloprotéine fer-soufre (Fe-S), de masse moléculaire de 24 à 36 kD. La plus grande est une métalloprotéine fer-molybdène (Fe-Mo), de masse moléculaire de l’ordre de 220 kD.
Dans les protéines I Fe-Mo, le site catalytique est généralement constitué, comme dans le cas de la molybdoptérine, d’un atome de molybdène (cf. Molybdène), dans lequel l’atome de soufre est parfois remplacé par du sélénium (cf. Soufre, Sélénium). Quant au molybdène, il est remplacé par du vanadium (cf. Vanadium) dans les bactéries du genre Azobacter.
Les nitrogénases à vanadium sont 100 fois moins efficaces que celles à molybdène, mais peuvent catalyser la conversion du monoxyde de carbone en alcanes, via une réaction analogue à la synthèse de Fischer-Tropsch (cf. Monoxyde de carbone).
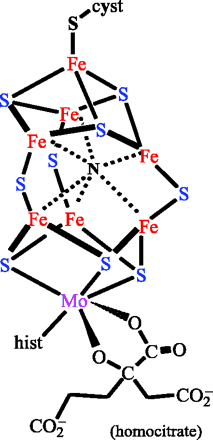
La réduction du diazote se déroule en deux temps. Lors de la première étape A, l’ATP est fixé sur la protéine Fe-S II, laquelle est réduite par un donneur primaire d’électrons, comme la ferrédoxine Fdx (ou la flavodoxines (Flx). La ferrédoxine est une petite protéine (de 14 à 24 kD) contenant un groupement fer-soufre. Le cluster [4Fe-4S]2+ est réduit en [4Fe-4S]+ par transfert d’un électron. Les électrons sont transportés par le fer, qui peut se trouver soit à l’état de fer ferreux, réduit (Fe(II)) soit à l’état de fer ferrique, oxydé (Fe(III)). La ferrédoxine participe non seulement à la fixation de l’azote, mais elle est aussi un transporteur d’électrons important dans la photosynthèse.
Lors de la seconde étape B, la protéine II réduite se lie à la protéine Fe-Mo I, et transfère les électrons à la protéine Fe-Mo (I). L’ATP est alors hydrolysée en ADP, avec transfert d’un électron au centre dit P de la protéine Fe-Mo (cluster [7Fe-8S]). L’étape suivante, C, est la dissociation de cet ensemble avec libération d’ADP lié à la protéine Fe-S. La protéine Fe-Mo accumule les électrons nécessaires pour finalement réduire le diazote gazeux (étape D) et produire une molécule de dihydrogène.
Les nitrogénases catalysent de très nombreuses réactions de réduction, comme la conversion de l’acétylène en éthylène, de N2O et [N3]– en azote, de CO2 en CO et H2O, etc. Des analogues synthétiques comme les complexes de coordination (Et4N)2Fe4S4(SCH2Ph)4] ou [HIPTN3N]Mo(N2) permettent la transformation du diazote à pression et température ordinaire en présence de réducteurs puissants, comme le décaméthylchromocène, et d’une source de protons, comme un sel de pyridinium.
Les bactéries du genre{ Frankia, de la classe des actinobactéries, à laquelle appartiennent les {Streptomyces, productrices d’antibiotiques, et les {Mycobacterium (dont font partie les agents de la tuberculose et de la lèpre !), sont également des fixatrices d’azote, inductrices de diazovésicules, qui colonisent des plantes comme les aulnes et les myriques.
Pourquoi les plantes et/ou les bactéries forment-elles des hétérocystes, nodules ou vésicules, dès qu’il y a infection ? Probablement parce que l’oxygène est un poison pour les nitrogénases, qui doivent par conséquent en être protégées. Cela impliquerait donc que reconnaissance réciproque de la bactérie et de la plante, infection, formation de nodules et libération des nitrogénases sont des processus liés, voire concomitants. Mais alors, quel est le signal déclenchant ? Est-il chimique ? Ce sera l’objet d’un prochain épisode « Dialogues moléculaires plantes-microorganismes ».
Pensée du jour
« Mais oui, c’est bien la chimie qui mène le monde… »
Sources
– http://en.wikipedia.org/wiki/Nitrogen_fixation
– http://en.wikipedia.org/wiki/Beijerinck
– H. Bortels, Arch. Mikrobiol. 1930, 1, 333.
– http://fr.wikipedia.org/wiki/Chimie_bioinorganique
– http://pt.wikipedia.org/wiki/Nitrogenase
– www.cse.scitech.ac.uk/ccg/j.kaestner/nitrogenase.html
– www.ebiologie.fr/doc-cours-cours-de-physiologie-vegetale-ii-157.html
– http://en.wikipedia.org/wiki/Cofactor_(biochemistry)
– http://en.wikipedia.org/wiki/Iron-sulfur_protein
– http://rsta.royalsocietypublishing.org/content/363/1829/959.full
– M.K. Johnson, A.D. Smith, Iron–sulfur proteins dans : {Encyclopedia of Inorganic Chemistry (R.B. King, Ed.), 2nd edn, John Wiley & Sons, Chichester, 2005.
– http://rstb.royalsocietypublishing.org/content/361/1474/1787.abstract
– www.genoscope.cns.fr/spip/Frankia-alni-symbiotique-fixatrice.html
– http://en.wikipedia.org/wiki/Alkaline-spring_hypothesis#Proto-ecological_systems
Pour en savoir plus
– ATP
– Chlorophylle
– Molybdène
– Soufre
– Sélénium
– Vanadium
– Monoxyde de carbone

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie