Le peroxyde d’hydrogène a été isolé pour la première fois en 1818 par Louis Jacques Thénard en faisant réagir du peroxyde de baryum avec de l’acide nitrique. Il s’agit d’un liquide de couleur bleue pâle, légèrement plus visqueux que l’eau, mais incolore en solution. Concentré, c’est un produit instable. Le peroxyde d’hydrogène pur a été obtenu par Richard Wolffenstein en 1894 par distillation sous vide. La concentration des solutions de peroxyde d’hydrogène est parfois indiquée en volumes : une solution à x volumes correspond au dégagement de x litres de dioxygène par la décomposition d’un litre de solution.
La formule du peroxyde d’hydrogène a été également établie à la fin du XIXe siècle par Petre Melikishvili. Les études structurales en phase gazeuse et à l’état cristallisé montrent que c’est une molécule non planaire possédant un axe de symétrie C2. Ce serait donc une molécule chirale, mais en fait elle se racémise très facilement.
Le peroxyde d’hydrogène se décompose exothermiquement en eau et dioxygène (cf. Dioxygène) :
2 H2O2 ———> 2 H2O + O2
En fait cette réaction se décompose en deux étapes d’oxydo-réduction :
H2O2 + 2 H+ + 2 e– ———> 2 H2O (où H2O2 est l’oxydant),
H2O2 ———> O2 + 2 H+ + 2 e– (où H2O2 est le réducteur)
Le peroxyde d’hydrogène est incompatible avec de nombreuses substances qui catalysent sa décomposition : c’est plus précisément le cas de la plupart des métaux de transition et de leurs composés. L’un des catalyseurs les plus communs est le dioxyde de manganèse (cf. Oxydes de manganèse). Cette réaction est également catalysée {in vivo dans le foie par la catalase (cf. Cytochrome P450) dont l’action principale est l’élimination des sous-produits toxiques du métabolisme et la diminution du stress oxydant (cf. Dioxygène). Toutefois, en présence de certains ions métalliques cette décomposition est de type radicalaire, avec la formation de radicaux hydroxyle (OH•) ou hydroperoxyde (HOO•) : c’est le cas du réactif de Fenton, association de l’ion Fe(II) et du peroxyde d’hydrogène.
En milieu acide, le peroxyde d’hydrogène est un des plus puissants oxydants connus, plus puissant que le chlore, le dioxyde de chlore et le permanganate de potassium. En outre, associé au Fe(II), il engendre des radicaux hydroxyle extrêmement réactifs. En milieu alcalin, il se comporte comme un réducteur, convertissant par exemple l’ion permanganate en dioxyde de manganèse. En chimie organique, le peroxyde d’hydrogène est un agent d’oxydation (milieu acide) d’hétéroatomes, notamment le soufre(II) et d’époxydation (milieu alcalin) d’oléfines pauvres en électrons, comme les acrylates.
La synthèse du peroxyde d’hydrogène paraît… élémentaire, à partir du dioxygène et du dihydrogène : H2 + O2 ———> H2O2
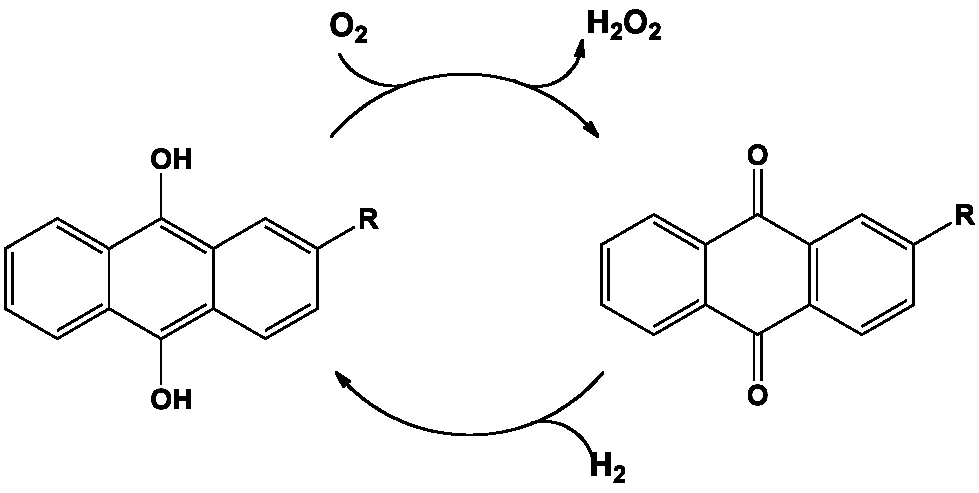
C’est bien ce qui est mis en œuvre dans le procédé Riedl-Pfleiderer découvert en 1936, mais qui met en œuvre un couple de molécules organiques pour y parvenir : c’est la synthèse d’un produit inorganique à partir d’un substrat organique, l’anthrahydroquinone ou ses dérivés alkyle en C-2, par autoxydation avec le dioxygène.
La plupart des procédés commerciaux emploient le bullage d’air comprimé dans une solution d’anthrahydroquinone, le dioxygène de l’air réagissant avec les atomes d’hydrogène des groupements hydroxyle pour former le peroxyde d’hydrogène et libérer l’anthraquinone correspondante. Le peroxyde d’hydrogène est extrait et l’anthraquinone réduite par le dihydrogène en présence de catalyseurs métalliques pour un nouveau cycle redox.
D’autres procédés mettant directement en œuvre dioxygène et dihydrogène dans une réaction catalysée par des nanoparticules de palladium et/ou d’or (cf. Palladium) sont activement étudiés, mais conduisent encore à de faibles rendements.
Environ 2,5 Mt de peroxyde d’hydrogène sont produites annuellement selon le procédé Riedl-Pfleiderer. Plus de 50 % de cette production sont consommés par l’industrie papetière pour blanchir la pâte à papier, qui l’emploie de plus en plus de préférence au dichlore (cf. Chlore), car moins polluant, puisqu’à côté des produits d’oxydation, seulement de l’eau est formée comme autre sous-produit. Pour les mêmes raisons le peroxyde d’hydrogène remplace de plus en plus le dichlore dans la production d’eau potable.
Enfin, rappelons que le peroxyde d’hydrogène peut servir de comburant pour la propulsion de fusées (cf. Hydrazine). En se décomposant dans le réacteur, il fournit le dioxygène nécessaire à la combustion des combustibles auxquels il est associé. Il a la particularité de pouvoir être aussi utilisé seul comme monergol dans les Rocketbelt de James Bond ou du spectacle d’ouverture des JO de Los Angeles. Dans ce cas, c’est la décomposition exothermique du peroxyde d’hydrogène concentré, induite dans la chambre du réacteur par contact avec un catalyseur, qui produit un jet d’oxygène et de vapeur d’eau à 600 °C.
Pensée du jour
« Le baron Louis Jacques Thénard, Pair de France, mais aussi père du peroxyde d’hydrogène ! »
Sources
– http://fr.wikipedia.org/wiki/Peroxyde_d’hydrogène
– www.societechimiquedefrance.fr/extras/Donnees.htm
– http://en.wikipedia.org/wiki/Hydrogen_peroxide
Pour en savoir plus
– Dioxygène
– Oxydes de manganèse
– Cytochrome P450
– Palladium
– Chlore
– Hydrazine

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie