Le polychlorure de vinyle a été découvert par accident à au moins deux occasions au cours du XIXe siècle, d’abord en 1835 par Henri Victor Regnault, un assistant de Justus von Liebig, et en 1872 par le chimiste allemand Eugen Baumann. Dans les deux cas, le polymère est apparu comme un solide blanc dans des bouteilles de chlorure de vinyle après exposition à la lumière solaire.
Ce fut le point de départ du succès commercial du PVC qui demandait alors comme matières premières l’acétylène dont c’était l’âge d’or (cf. {Acétylène) et l’acide chlorhydrique (cf. {Acide chlorhydrique), sous-produit de nombreux procédés industriels qui trouvait là un débouché intéressant : le PVC contient près de 60 % en masse de chlore…
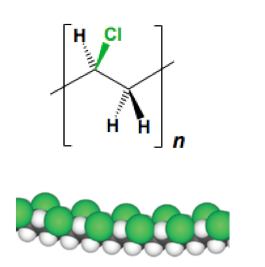
Le polychlorure de vinyle est obtenu par polymérisation radicalaire du chlorure de vinyle, CH2=CHCl. Cette polymérisation en présence d’initiateurs de radicaux et d’éventuels adjuvants peut être réalisée selon trois procédés :
-** en suspension dans l’eau (80 % de la production mondiale). La température de réaction est de 50 à 70 °C, le volume des autoclaves de 80 à 150 m3, la durée d’un cycle de l’ordre de 8 heures. Les produits obtenus sont transparents, avec une faible absorption d’eau,
-** en émulsion dans l’eau (10 % de la production mondiale). Il se forme des produits non transparents, faciles à mettre en œuvre et ayant tendance à absorber l’eau,
-** en masse (10 % de la production mondiale). Le PVC est de ce fait exempt d’adjuvant, ce qui permet d’obtenir des produits encore plus transparents et brillants. Ce procédé est développé par Total Petrochemicals.
On ajoute le plus souvent au PVC des plastifiants afin d’améliorer certaines caractéristiques (souplesse, allongement à la rupture, tenue au froid et aux chocs, etc.) ou de faciliter la mise en œuvre. Les phtalates, notamment le phtalate d’éthyl-2-hexyl (cf. {Rhodium) sont des plastifiants très utilisés, mais reconnus comme perturbateurs endocriniens. Au cours du temps, ils peuvent migrer du fait de l’incompatibilité avec la matrice polymère et se déposer en surface des objets souples en PVC.
D’autres plastifiants sont autorisés, dans la famille des adipates ou même des huiles végétales (huile de soja par exemple). Ils permettent depuis de nombreuses années la fabrication du film étirable alimentaire. Cependant, au contact des corps gras des aliments, certains plastifiants hydrophobes migrent dans la nourriture.
Il existe de nombreuses utilisations du PVC dans l’industrie employant trois types de PVC :
-** le PVC rigide a un aspect lisse et est typiquement employé dans les matériaux de construction : tuyaux de canalisation, fenêtres, aménagements d’intérieur, etc.,
-** le PVC souple a un aspect brillant que l’on retrouve dans les tissus et les papiers imprégnés, les revêtements de sol et les plafonds tendus, mais aussi pour ses propriétés isolantes dans les câbles électriques,
-** les films de PVC plastifié utilisé sous forme de film adhésif pour lamination ou sous forme de film étirable pour emballage.
{Incinération et recyclage
L’incinération du polychlorure de vinyle dégage majoritairement de l’acide chlorhydrique. A l’heure actuelle, toutes les usines d’incinération d’ordures ménagères homologuées sont munies de filtres anti-acides, car il y a des chlorures dans de nombreux déchets. Selon Greenpeace, la combustion du PVC engendre des dioxines (cf. {Dioxines) et furanes en quantités variables selon les conditions de combustion. En fait, de nombreuses études européennes ont montré que le chlore présent dans les dioxines émises lors de la combustion des ordures ménagères ne provenait pas de l’acide chlorhydrique présent dans les gaz de cheminée, mais de réactions en phase solide entre des chlorures inorganiques et des particules de cendres contenant des goudrons.
Jusqu’en 2 000, le PVC n’était pas considéré comme un matériau recyclable, son coût étant moindre que le coût de sa récupération. Depuis, des programmes ont été lancés, notamment en Europe pour collecter et reconditionner le PVC. Un programme actuel porterait sur le recyclage de 800 kt/an, à mettre en rapport avec la production mondiale de PVC qui avoisine les 40 Mt/an, dont 8 en Europe…
{Le chlorure de vinyle
Le chlorure de vinyle a été produit pour la première fois en 1835 par Justus von Liebig et son assistant Henri Victor Regnault. Ils l’ont obtenu par traitement du 1,2-dichloroéthane avec une solution d’hydroxyde de potassium dans l’éthanol. En 1912, Fritz Klatte, un chimiste allemand travaillant pour Griesheim-Elektron, a fait breveter un procédé pour produire le chlorure de vinyle à partir de l’acétylène et de l’acide chlorhydrique en utilisant le chlorure mercurique comme catalyseur :
CH≡CH + HCl ———> CH2=CHCl
Cette méthode a été couramment employée pendant les années 30 à 40. Depuis elle a été remplacée par des procédés plus économiques et moins polluants (cf. {Mercure).
Le chlorure de vinyle est actuellement produit à partir de l’éthylène (cf. {Éthylène) et du chlore (cf. {Chlore). En présence de chlorure ferreux agissant comme catalyseur, ces composants produisent du dichloroéthane selon l’équation :
CH2=CH2 + Cl2 ———> ClCH2CH2Cl
A 500 °C sous une pression de 30 bar, le 1,2-dichloreéthane se décompose pour produire du chlorure de vinyle et de l’acide chlorhydrique :
ClCH2CH2Cl ———> CH2=CHCl + HCl
L’acide chlorhydrique produit dans cette étape est recyclé. Mélangé à de l’oxygène et mis à réagir en présence de chlorure cuivrique avec de l’éthylène additionnel, il produit du 1,2-dichloreéthane :
CH2=CH2 + 2 HCl + 0,5 O2 ———> ClCH2CH2Cl + H2O
Pensée du jour
« {Inaccessible par VPC, impossible à analyser par CPV, il vaut mieux dire PVC que PCV, et pourtant c’est bien le polychlorure de vinyle ! »
Sources
– http://fr.wikipedia.org/wiki/Polychlorure_de_vinyle
– http://fr.wikipedia.org/wiki/Chlorure_de_vinyle
– www.societechimiquedefrance.fr/extras/Donnees/mater/pvc/cadpvc.htm
– www.inrs.fr/htm/chlorure_de_vinyle.html
– http://encyclopedia.airliquide.com/encyclopedia.asp?GasID=104&CountryID=19&LanguageID=2
– http://en.wikipedia.org/wiki/Vinyl_chloride
– http://en.wikipedia.org/wiki/Polyvinyl_chloride
Pour en savoir plus
– Polyéthylène
– Polypropylène
– Acétylène
– Acide chlorhydrique
– Rhodium
– Dioxines
– Mercure
– Éthylène
– Chlore

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie 

