Jusqu’au XVIIIe siècle, aucune distinction n’était faite entre le potassium et le sodium (cf. Sodium), du fait de l’absence de différenciation entre «alcali végétal» : le carbonate de potassium, K2CO3, présent dans les cendres de végétaux (bois, feuilles), et «alcali minéral» : le carbonate de sodium, Na2CO3, extrait du sol (cf. {Carbonate de sodium). Pour la petite histoire, cet «alcali végétal» était obtenu par extraction de cendres avec de l’eau avant concentration par évaporation, d’où son nom anglais « {potash », union de pot et ash. Le potassium a été isolé en 1807 par Sir Humphry Davy, qui l’a obtenu par l’électrolyse de la potasse caustique, KOH, fondue. Davy isola le sodium par un procédé semblable quelques mois plus tard.

Les sels naturels solubles sont surtout les chlorures tels que la carnallite, KMgCl3•6 H2O, la langbeinite, K2Mg2(SO4)3, la polyhalite, K2Ca2Mg(SO4)4•2 H2O, et la sylvine, KCl (ci-dessous), que l’on trouve au fond des anciens lacs et mers.

Seule la concentration par évaporation des eaux de la Mer Morte (cf. {Brome) fait cristalliser le chlorure de sodium (cf. {Chlorure de sodium) puis la carnallite, KMgCl3.6 H2O.
En gisement fossile, la « potasse » s’extrait habituellement par mine (puits et galeries) et rarement par dissolution {in situ (saumure pompée). Après élimination éventuelle des impuretés, les sels sont généralement séparés par deux procédés : la cristallisation fractionnée et la flottation. La première est utilisée pour la sylvinite et la carnallite. En Alsace, on employait la flottation pour la sylvine broyée et dispersée dans une eau mère froide : par de tensioactifs à base d’amines grasses à longue chaîne, la sylvine était entraînée par la mousse vers la surface.
Le potassium était principalement obtenu par électrolyse de l’hydroxyde de potassium fondu jusque dans les années 1920. Actuellement, il se se prépare par voie thermochimique, le réducteur étant le sodium pour le chlorure de potassium et l’hydroxyde de potassium :
Na + KCl ———> NaCl + K
et le carbure de calcium (cf. Acétylène, Henri Moissan) pour les chlorure et fluorure de potassium :
2 KF + CaC2 ———> 2 K + CaF2 + 2 C
L’hydroxyde de potassium, KOH, s’obtient industriellement par électrolyse du chlorure KCl en solution aqueuse, avec production simultanée de dichlore (cf. {Chlore) et de dihydrogène (cf. {Hydrogène).
Le potassium est le second métal le plus léger après le lithium. C’est un solide mou qui est facilement coupé à l’aide d’un couteau, et comme le sodium, très sensible à l’air et réagissant violemment avec l’eau. De configuration électronique [Ar]4{s1, c’est un élément très électropositif qui perd facilement son électron de valence 4s1 en formant avec les éléments non métalliques des composés à liaisons ioniques.
Les isotopes naturels de masse 39, 40 et 41 ont des teneurs respectives de 93,25 %, 0,012 % et 6,73 %. Il existe aussi des isotopes artificiels de masse 32 à 38 et 42 à 55. L’isotope 40K radioactif (demi-vie : 1,248 milliard d’année), émetteur β et γ, est responsable de la moitié de la radioactivité naturelle du corps humain qui contient en moyenne 35 g de potassium. Sa transmutation partielle en 40Ca (89,3 %) et 40Ar (10,7 %) occlus dans les roches est dosable par spectrométrie de masse et conduit à la détermination de leur âge, en plus de conduire à la teneur anormale de l’argon dans l’atmosphère (cf. {Néon & Cie).
Le superoxyde, KO2, et l’oxylithe, dérivé peroxydé de l’alliage NaK, s’emploient comme sources d’oxygène et épurateurs d’atmosphère (appareils respiratoires autonomes et vaisseaux spatiaux ou sous-marins). Ils absorbent le dioxyde de carbone et la vapeur d’eau expirés en libérant de l’oxygène :
2 KO2 + H2O + 2 CO2 ———> 2 KHCO3 + O2
L’hydroxyde et le carbonate interviennent dans la fabrication des savons mous et des décapants de peinture. Le carbonate, employé surtout en verrerie et émaillerie, comme le nitrate et le sulfate, permet aussi la fabrication d’autres sels potassiques. Le nitrate (le bien connu salpêtre) et le chlorate s’emploient en pyrotechnie (cf. {Feux d’artifice) : la poudre noire est un mélange 2 KNO3 + S8 + 3 C, servant maintenant à la fabrication des allumettes. Le chlorate est un herbicide comme l’analogue sodique. Les silicates en solution aqueuse, « liqueur des cailloux », durcissent les pierres calcaires trop tendres.
On emploie les halogénures KBr et KI en médecine et en photographie. Le pentasulfure, K2S5, constituant du « foie de soufre », permet de préparer des bains sulfureux artificiels. L’hydrogénosulfite, KHSO3, est un agent désinfectant et un réactif photographique et l’hydrogénocarbonate, KHCO3, constitue une poudre extinctrice. D’autres sels s’utilisent surtout comme réactifs : cyanure, KCN (cf. {Acide cyanhydrique), hexacyanoferrates K4Fe(CN)6] et K3[Fe(CN)6], thiocyanate, KSCN, chromate K2CrO4 et bichromate K2Cr2O7, permanganate KMnO4 (cf. [{Permanganate).
Toutefois, l’essentiel de la production de potassium (31,5 Mt/an en équivalent K2O) concerne les engrais, essentiel pour la croissance des plantes. Dans l’industrie des engrais, le terme « potasse » désigne encore le chlorure de potassium, KCl, dont la teneur en élément fertilisant (K+) s’exprime sous forme d’oxyde K2O, ce qui entraîne des confusions supplémentaires avec le carbonate, K2CO3. Les principaux engrais potassiques sont : le chlorure ou sylvine (58 à 63 % de K2O), la sylvinite (25 % de K2O), la sylvinite double (40 % de K2O), le sulfate (48 % de K2O), l’hydrogénocarbonate (46 % de K2O), le nitrate (44 à 47 % de N et 13 à 14 % de K2O), les binaires phosphapotassiques, mélanges de phosphates (cf. {Acide phosphorique) et de sylvine, ou composés, tel le polymétaphosphate (57 % de P2O5 et 37 % de K2O).
Les sels de potassium sont essentiels aux règnes animal et végétal. Le cation potassium, K+, est le principal cation des fluides intracellulaires, le cation sodium, Na+, étant le plus important cation extracellulaire. Leur bon rapport est essentiel au fonctionnement du système nerveux, du cœur et des muscles en général. Celui-ci est assuré par la pompe sodium-potassium ou Na+-K+ATPase qui permet d’échanger les ions sodium issus du milieu intracellulaire avec les ions potassium issus du milieu extracellulaire dans un rapport précis (3 Na+/2 K+). Cette pompe est responsable du rétablissement de l’équilibre initial après un potentiel d’action.
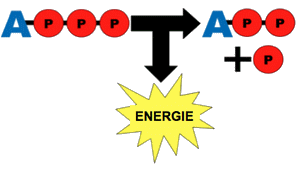
La Na+-K+ATPase est une enzyme transmembranaire dont l’activité utilise l’énergie issue de la dégradation de l’ATP en ADP et phosphore inorganique, Pi (cf. {ATP & ADP), pour transporter des ions potassium et sodium contre leur gradient de concentration.
Le mécanisme de transport actif d’ions par les ATPases de type P s’explique par l’alternance de deux états conformationnels et l’existence de plusieurs équilibres d’affinité entre les espèces ioniques, l’ATP et la pompe dans ses deux états :
-** la pompe en associant une molécule d’ATP, lie 3 ions Na+ intracellulaires,
-** l’ATP est hydrolysé, menant à phosphorylation d’un résidu aspartate et formation d’une molécule d’ADP,
-** un changement conformationnel de la pompe permet le transfert des ions Na+ vers l’extérieur du fait d’une faible affinité de la pompe phosphorylée pour des ions Na+,
-** la pompe lie 2 ions K+ extracellulaires, induisant la déphosphorylation de la pompe, la ramenant à son état conformationnel initial, transportant les ions K+ dans la cellule,
-** la forme non phosphorylée de la pompe possède une affinité plus élevée pour les ions Na+ que pour les ions K+, ce qui permet le relargage de ces deux ions. La liaison d’une molécule d’ATP assure le démarrage d’un nouveau cycle.
Un régime normal, contenant des quantités raisonnables de légumes et surtout de fruits (vous savez : 5 fruits et légumes…), apporte le potassium quotidiennement nécessaire, d’où la
Pensée du jour :
«{Le potassium potasse de nombreuses solutions pour votre bien-être.»
Sources :
– http://fr.wikipedia.org/wiki/Potassium
– http://en.wikipedia.org/wiki/Potassium
– www.periodicvideos.com/videos/019.htm
– http://minerals.usgs.gov/minerals/pubs/commodity/potash/mcs-2011-potas.pdf
– http://fr.wikipedia.org/wiki/Pompe_sodium-potassium
– www.scribd.com/doc/2079753/SodiumPotassium-Pump-on-Wikipedia-Portrait
– http://en.wikipedia.org/wiki/Na+/K+-ATPase
Pour en savoir plus :
– Sodium
– Carbonate de sodium
– Brome
– Chlorure de sodium
– Acétylène
– Henri Moissan
– Chlore
– Hydrogène
– Néon & Cie
– Feux d’artifice
– Acide cyanhydrique
– Permanganate
– Acide phosphorique
– ATP & ADP

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie