Découvert avec le tellure en 1817 par Jöns Jacob Berzélius et par Johan Gottlieb Gahn, dans le résidu de préparation de l’acide sulfurique (cf. Acide sulfurique), le sélénium appartient à la famille des chalcogènes, du grec ancien χαλkός (khalkós : bronze, airain), car on trouvait le minerai de cuivre (cf. Cuivre) sous forme d’oxyde, de sulfure, etc. Les chalcogènes réunissent les éléments de la colonne 16 du tableau de Mendeleiev (cf. Dimitri Mendeleiev) ; le sélénium se trouve entre l’oxygène (cf. Dioxygène) et le soufre (cf. Soufre) d’une part et d’autre part, le tellure suivi du polonium, (élément radioactif) et de l’ununhexium, Uuh, élément artificiel (cf. Copernicium). Tous ces composés ont une structure électronique de valence de type n{s2n{p4 ou n{s2(n-1){d10n{p4, forment des liaisons covalentes ou captent 2 électrons (oxydes, sulfures, séléniures…). Il peut en perdre 4 et former des sélénites ou 6 pour donner des sélanates.
Les chalcogènes appartiennent au bloc « {p », qui intègre les éléments des colonnes 13 à 16, correspondant au remplissage du niveau électronique « {np ». Dans ce bloc, les éléments d’une colonne ne possèdent pas des propriétés chimiques communes, au contraire de ce qui est observé en général, par exemple pour les halogènes (colonne 17). Le bloc est traversé par la diagonale des métalloïdes, avec à sa droite, des non-métaux (dans la colonne 16 : O, S, Se) :
|Période N°|Colone N°|<|<|<| ||13|14|l15|16| |2|B|C|N|O|
|3|Al|Si|P|S|
|4|Ga|Ge|As|Se|
|5|In|Sn|Sb|Te|
|6|Ti|Pb|Bi|Po|
|7|Uut|Uuq|Uup|Uuh|
Le sélénium possède 29 isotopes, dont 5 sont stables, les plus abondants étant 78Se (23,78 %) et 80Se (49,61 %). L’isotope naturel 79Se est un produit de fission de durée de vie longue (demi-vie : 327 000 ans) : il sert actuellement à suivre le devenir des déchets nucléaires enfouis.
Il possède trois formes allotropiques. La plus stable, grise, est constituée de chaines hélicoïdales, et présente la particularité de mieux conduire l’électricité à la lumière que dans la noirceur. La seconde, rouge brique, est constituée de cycles Se8 en analogie avec le soufre.
Chauffée rapidement, cette variété conduit à un produit noir, vendu sous forme de perles.

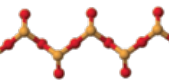
A l’exception de l’eau, les hydrures des éléments de la colonne 16 sont gazeux, de moins en moins stables, et de plus en plus nauséabonds et toxiques. Ce sont des acides de plus en plus forts. Les halogénures de sélénium peuvent avoir des degrés d’oxydation +1, +2, et +4, avec des tétramères Se4X16. L’hexafluorure de sélénium SeF6 est encore plus toxique que son analogue SF6. Les disulfures de sélénium, des mélanges de formule moyenne (SeS2)n, sont utilisés dans les shampooings antipelliculaires, comme inhibiteurs de polymérisation. Dans les industries du verre et des feux d’artifice, on utilise les sélénio-sulfures de cadmium dits rouges de cadmium comme colorants.
|3 Se + 4 HNO3 ———> 3 H2SeO3 + 4 NO
Appliqué sur la surface de l’acier, l’acide sélénieux « bronze » la surface des petites pièces, en particulier d’armes à feu. Ses sels sont des sélénites, d’argent (Ag2SeO3), de sodium (Na2SeO3), etc. Quant à l’acide sélénique, obtenu par action du peroxyde d’hydrogène (cf. Peroxyde d’hydrogène), il est capable, lorsqu’il est chaud et concentré, de dissoudre l’or, formant un séléniate d’or.
Avec les métaux de transition, le sélénium (comme le soufre et le tellure) forme des composés non stœchiométriques, des verres et des alliages. On connaît de nombreux séléniures, de mercure, de plomb, de zinc, et des composés plus complexes comme le diséléniure (Cu(Ga,In)Se2) ou encore CuInSe9 pour la fabrication de cellules photovoltaïques de grande taille. Les séléniures de métaux alcalins réagissent avec le sélénium pour former des polyséléniures, [Sex]2-. Leurs propriétés physiques et leurs domaines d’application possibles font encore l’objet de nombreuses études.
ROOH + 2 GSH → ROH + GSSG + H2O
Le sélénium possède également des propriétés immuno-modulatrices. Il intervient dans le métabolisme des hormones thyroïdiennes par l’intermédiaire d’une désiodinase qui est une sélénoprotéine (cf. Tyrosine).
Une carence en sélénium, très rare en France, est à l’origine de graves problèmes cardiaques, osseux, ou neuro-musculaires. La teneur des sols en sélénium, très variable selon les zones géographiques, conditionne les apports de l’alimentation : il est présent dans les céréales, les noix, le poisson, le foie, etc. Une carence modérée pourrait favoriser l’apparition de certains cancers, le déclin des fonctions cognitives, ainsi que la survenue ou la progression d’infections virales comme le VIH. Chez les sujets âgés, le maintien des apports par la nutrition ou par les compléments alimentaires à dose nutritionnelle (50 à 100 μg/j) est essentiel. Une supplémentation à dose supranutritionnelle (200 μg/j) serait efficace dans la prévention de certains cancers, de la prostate en particulier, mais le risque de toxicité doit être soigneusement évalué. Car le sélénium et la plupart de ses dérivés sont violemment toxiques, et la limite entre dose nécessaire et dose dangereuse est parfois difficile à déterminer. L’ANSES vient d’émettre un avis négatif (juin 2011) concernant un mélange de sélénites triglycérides issus de la transformation chimique d’huile de tournesol pour la boulangerie.
Pensée du jour
« D’une étincelante beauté, Séléné eut, dit-on, 50 amants, comme le sélénium a d’isotopes…. »
Sources
– http://fr.wikipedia.org/wiki/Sélénium
– www.udppc.asso.fr/national/index.php/component/content/article/40/411-chalcogenes-presentation
– http://en.wikipedia.org/wiki/Selenium
– http://en.wikipedia.org/wiki/Selenosis#Toxicity
– www.vulgaris-medical.com/encyclopedie/selenium-4211.html
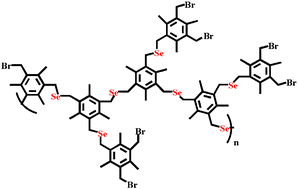
– H. Xu, J. Gao, Y. Wang, Z. Wang, M. Smet, W. Dehaen, X. Zhang, {Hyperbranched polyselenides as glutathione peroxidase mimics, {Chem. Commun. 2006, 796-798.
– www.mdpi.com/1420-3049/14/9/3115
– A.-M. Roussel, I. Hininger-Favier, {Eléments-traces essentiels en nutrition humaine : chrome, sélénium, zinc et fer, EMC (Elsevier Masson SAS), Endocrinologie-Nutrition, 2009, 10-359-B-10.
– www.anses.fr/AnsesAvisRapportsfr.rss
Pour en savoir plus
– Acide sulfurique
– Cuivre
– Dimitri Mendeleiev
– Dioxygène
– Soufre
– Copernicium
– Peroxyde d’hydrogène
– Tyrosine

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie