Le zirconium, de symbole Zr et de numéro atomique 40, se place dans la classification périodique entre l’yttrium et le niobium et appartient à la même 4ème colonne que le titane et l’hafnium. Sa configuration électronique [Kr]4{d25{s2 montre que la valence stable sera 4+.
Relativement abondant dans la croûte terrestre il se trouve sous forme de zircon qui est le silicate de zirconium ZrSiO4, à ne pas confondre avec la zircone (zirconia en anglais) qui est l’oxyde de zirconium ZrO2. Le zircon est connu depuis l’antiquité, puisqu’en Egypte des bijoux à base de zircon on été découverts en forme du dieu scarabée Khepri. Le nom zirconium est dérivé de ce minerai ; il vient de l’allemand Zirkon d’après le géologue Abraham Gottlob Werner qui lui donna ce nom en 1783 et que Martin Heinrich Klaproth reprit en 1789. L’origine de cette formulation allemande reste cependant encore obscure.
La fabrication du zirconium n’est pas facile car l’énergie réticulaire du silicate et de l’oxyde de zirconium est importante et nécessite une réduction énergique à haute température. On opère d’abord par une chloro-réduction : ZrO2 + 2C + 2Cl2 ———> ZrCl4 + 2CO
mais comme les minerais contiennent de l’hafnium, on obtient un mélange (Zr,Hf)Cl4 dont la purification est accomplie par distillation qui sépare HfCl4 et ZrCl4. Le chlorure de zirconium est ensuite traité dans un four à haute température avec du magnésium (procédé Kroll) :
ZrCl4 + 2Mg ———> Zr + 2 MgCl2
Par traitement sous vide, on vaporise le magnésium et on obtient les éponges de zirconium. En France, ce sont les usines CEZUS qui produisent près de 2 000 t de zirconium et ses alliages à Jarrie (éponges) et Ugine (alliages).
Métallique, le zirconium est de structure hexagonale avec une transformation structurale hexagonale –cubique centrée à 963 °C. C’est sous forme d’alliage, le zircaloy qu’il est très utilisé dans l’industrie nucléaire et l’industrie chimique. Il existe plusieurs nuances de zircaloy qui contiennent au moins 98,2 % de zirconium, 1,45 % d’étain (cf. Étain) et un peu de fer et de chrome (cf. Chrome). Pour les applications nucléaires dans les réacteurs à eau pressurisée (REP), le zircaloy doit contenir moins de 0,01 % d’hafnium. En effet, si le zirconium a une très faible section efficace d’absorption des neutrons, l’hafnium, lui, a une très forte section efficace qui lui permet, par exemple, d’être utilisé pour les barres de commande des réacteurs nucléaires embarqués dans les sous-marins nucléaires.
Le zircaloy constitue dans le réacteur les « crayons » qui sont des tubes fermés dans lesquels sont empilées des pastilles d’oxyde d’uranium enrichi UO2. Il forme donc le gainage du combustible qui chauffe l’eau sous pression du circuit primaire. Le problème du zircaloy, c’est que dans certaines conditions de haute température et de rayonnement intense il est fragilisé par le dihydrogène avec formations d’hydrures, moins denses, qui fissurent le tube.
Cependant, dans des conditions normales il est passivé par une couche fine sombre de zircone très stable.
En cas d’accident et de dénoyage, si le cœur n’est plus refroidi, et avec une montée en température excessive du combustible, le zirconium peut s’oxyder et même décomposer l’eau surtout si elle est à l’état de vapeur suivant la réaction : Zr + 2H2O ———> ZrO2 + 2H2 + Q
L’important dégagement d’hydrogène et la réaction exothermique peuvent occasionner des explosions : c’est ce qui s’est probablement passé au Japon à Fukushima lors de la destruction des bâtiments par défaut de refroidissement des réacteurs.
Un autre composé du zirconium qui a de nombreuses applications est son oxyde, la zircone, ZrO2. C’est un oxyde réfractaire (F = 2 950 K) qui présente plusieurs transformations structurales : à température ordinaire, il est monoclinique, à 1 165 °C, sa maille devient quadratique et, à 2 370 °C, sa structure devient cubique. La transformation quadratique-monoclinique s’accompagne d’une variation de volume importante de plus de 7 % qui est suffisante pour faire éclater les produits massifs. En conséquence de quoi, son utilisation sous forme céramique massive, exige une stabilisation de la forme cristalline quadratique. Cette stabilisation peut se réaliser par substitution de Y2O3 (cf. Yttrium) ou de CaO (cf. Chaux) de l’ordre de 5 à 10 %. Les zircones stabilisées sont utilisées comme hauts réfractaires sous forme de briques ou de revêtements des fours pour les hautes températures.
Par ailleurs, les propriétés électriques de la zircone au-dessus de 400 °C lui ont ouvert un champ d’application très intéressant, celui des capteurs et sondes à oxygène. En effet, la zircone stabilisée est un conducteur ionique par déplacement des ions oxygène dans son réseau cristallin.
Si, de chaque côté d’une paroi céramique de zircone, on crée une différence de pression partielle d’oxygène {pO2, on développe alors entre les deux surfaces une différence de potentiel proportionnelle à l’écart existant entre les pressions partielles. Comme la zircone est un réfractaire et que la réponse en conduction est meilleure à haute température, on s’en sert en automobile comme sonde λ qui, plongée dans les gaz d’échappement, fournit un signal à l’injection électronique pour régler le dosage air/carburant.
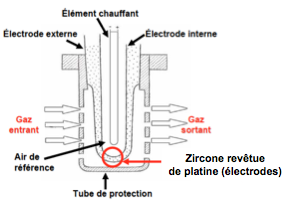
Il en est de même pour les sondes plongées dans l’acier en fusion dans les convertisseurs à oxygène qui transforment la fonte en acier en brûlant les métalloïdes C, S, Si… À la fin de la réaction la teneur en oxygène du bain fondu augmente brusquement, décelable immédiatement par un saut de tension aux bornes de la sonde.
– La dureté de la zircone frittée et le coefficient de réfraction de la lumière de ses monocristaux ont développé deux usages, hors prothèses dentaires :
– En coutellerie, les lames blanches en céramique zircone sont très dures et pratiquement inusables quoique fragiles aux chocs ; on ne doit plus les aiguiser, le seul inconvénient est qu’elles rayent la porcelaine.
– En joaillerie, les monocristaux de zircone peuvent être obtenus par fusion au chalumeau Verneuil (cf. Alumine) et aussi en auto-creuset. Par chauffage haute fréquence dans un creuset refroidi à l’eau, on amorce la fusion par des copeaux de zirconium qui couplent avec le champ HF et chauffent la zircone qui devient conductrice et couple à son tour jusqu’à la fusion. Les parois contre le creuset refroidi restent solides et contiennent la zircone fondue. Par refroidissement lent on peut obtenir des monocristaux massifs.
Taillés, les cristaux de zircone sont aussi beaux que les diamants (et moins coûteux).
Pensée du jour :
«Le zirconium est au réacteur nucléaire ce que le zircon est aux bijoux de la femme, c’est-à-dire indispensable.»
Sources :
– http://fr.wikipedia.org/wiki/Zirconium
– www.techniques-ingenieur.fr/search.html?view=view2&level=1&query=zirconium
– hwww.periodicvideos.com/videos/040.htm
– http://en.wikipedia.org/wiki/Zirconium
– http://elements.vanderkrogt.net/element.php?sym=zr
– http://fr.wikipedia.org/wiki/Zircone
– http://fr.wikipedia.org/wiki/Zircaloy
– www.eobd.fr/sonde_lambda.htm
– http://en.wikipedia.org/wiki/Oxygen_sensor
– www.google.fr/search?q=zirconium&ie

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie 

