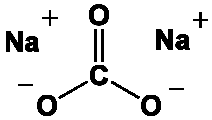
Il est connu depuis l’antiquité grâce aux gisements de « natron » qui sont constitués de roches évaporitiques dont la composition est proche de Na2CO3, 10H2O et du bicarbonate NaHCO3. Ce sont des cristaux blancs évanescents issus de l’évaporation de l’eau des lacs riches en sels de sodium dans plusieurs pays comme l’Egypte, la Lybie, le Tchad et les États-Unis.
A titre de curiosité, il faut également mentionner la montagne sacrée des Masaïs, l’Ol Doinyo Lengaï, le seul volcan au monde à émettre de la carbonatite, lave composée en majorité de carbonate de sodium, de teinte noire lorsqu’elle est en fusion et blanche lorsqu’elle refroidit.
Les égyptiens se servaient du natron pour le nettoyage des corps et la momification, non pas en solution, mais sous forme de poudre déshydratante comme technique de salage. Son utilisation qui remonte donc à la civilisation égyptienne était déjà connue pour le blanchiment du linge, le nettoyage, la conservation des viandes et des cuirs et, mélangé avec du sable et de la chaux (cf. Chaux), pour l’obtention de verres de diverses couleurs.
|2 NaCl + H2SO4 ———> Na2SO4 + 2 HCl
Na2SO4 + CaCO3 + 2C ———> Na2CO3 + CaS + 2 CO2
Dans le procédé Leblanc, il y a production d’acide chlorhydrique (cf. Acide chlorhydrique) lors de la première étape, puis lors de la réduction du sulfate de sodium, Na2SO4, par le calcaire et le coke, production de sulfure de calcium, CaS. Lors de la parution de « l’alkali act » au Royaume Uni en 1863, ces produits de réaction étaient considérés comme déchets, dont on se débarrassait dans les rivières et la nature, devenant ainsi hors la loi. La recherche de nouveaux procédés devenait nécessaire.
C’est un chimiste belge, Ernest Solvay, qui dès 1863 monta une première usine à Couillet avec un nouveau schéma de réactions : le procédé Solvay était né, il supplanta le procédé Leblanc dès 1870 et il est encore utilisé de nos jours. Le principe apparait simple :
2 NaCl + CaCO3 ———> Na2CO3 + CaCl2
En réalité, les étapes du procédé sont plus complexes. On forme d’abord une saumure de chlorure de sodium sur laquelle de l’ammoniac est absorbé. On crée ensuite un lait de chaux après calcination du carbonate de calcium (cf. Calcite) et la carbonatation de la saumure ammoniaquée conduit alors à la précipitation du bicarbonate de sodium, NaHCO3, qui, par calcination, conduit au carbonate de sodium, l’ammoniac étant ensuite recyclé.
Les produits comme le chlorure de calcium, CaCl2, sont valorisés comme sel de déneigement (cf. Calcium) plus respectueux de l’environnement que le chlorure de sodium. Le bicarbonate de sodium calciné forme également du dioxyde de carbone qui peut être recyclé pour donner un carbonate d’ammonium ou de calcium dans le bouclage du procédé.
2 NaHCO3 ———> Na2CO3 + H2O + CO2

2 (Na2 CO3 ,NaHCO3, 2H2 O) ———> 3 Na2 CO3 + 5 H2 O + CO2
Le carbonate est solubilisé dans l’eau pour séparer les impuretés insolubles puis à nouveau précipité et séché. Le coût est évidemment plus faible que par le procédé Solvay et les usines de production par synthèse qui étaient 16 aux États-Unis en 1950 ont disparu l’une après l’autre jusqu’en 1986.
La production mondiale de carbonate de sodium est de l’ordre de 45 Mt/an, le premier producteur étant la Chine depuis 2005 (18 Mt), suivie par les États-Unis (11Mt). La France en produit de l’ordre de 1Mt. C’est la société Solvay qui est leader suivie de Tata Chemicals, de FMC et OCI. En France, l’usine de Dombasle (Meurthe et Moselle), appartenant à Solvay, produit environ 700 000 t/an.
Les utilisations principales du carbonate de sodium sont :
– la fabrication du verre, essentiellement sodocalcique (Na-SiO2-CaO),
– l’emploi comme intermédiaire en chimie industrielle : phosphates, silicates (cf. Acide phosphorique),
– l’emploi comme intermédiaire dans la préparation de détergents, savons et lessives (Cf. Savons),
– la désulfuration des fontes en métallurgie,
– la préparation de céramiques pour l’émaillage (Cf. Émaux),
– dans l’industrie agroalimentaire comme antiagglomérant et régulateur de pH,
– dans l’industrie agroalimentaire comme agent de levuration. Le carbonate est un constituant de la levure chimique : mélangé à de l’acide tartrique (Cf. Acide tartrique), il dégage du dioxyde de carbone qui gonfle la pâte à pain ou celle des pâtisseries.
Pensée du jour
« De Natron en Trona, de Lybie au Wyoming, le carbonate fait la fortune des chimistes, encore une histoire belge ! »
Sources
– http://fr.wikipedia.org/wiki/Carbonate_de_sodium
– http://en.wikipedia.org/wiki/Sodium_carbonate
– http://fr.wikipedia.org/wiki/Procédé_Solvay
– http://www.solvaychemicals.com/EN/products/SodaAsh/SodaAsh_Home.aspx
– http://fr.wikipedia.org/wiki/Ol_Doinyo_Lengaï
– http://ngm.nationalgeographic.com/ngm/0301/feature2/zoom3.html
– http://fr.wikipedia.org/wiki/Ernest_et_Alfred_Solvay
Pour en savoir plus
– Chaux
– Chlorure de sodium
– Acide chlorhydrique
– Calcite
– Calcium
– Acide phosphorique
– Savons
– Émaux
– Acide tartrique

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie