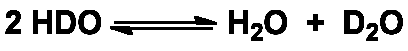En 1931, Harold C. Urey, Prix Nobel de Chimie 1934, et ses collaborateurs mettent en évidence l’existence du deutérium, isotope de l’atome d’hydrogène, en analysant les raies du spectre d’un résidu lourd de distillation fractionnée d’hydrogène liquide (cf. Hydrogène). En 1933, Gilbert N. Lewis, son mentor, isole le premier échantillon d’eau lourde pure par électrolyse.
Sur Terre, l’eau contenant du deutérium, HDO, est naturellement présente dans l’eau à une proportion d’environ 1 molécule pour 3 200. La molécule HDO peut être séparée de l’eau « légère », 1H2O par distillation ou électrolyse, mais aussi par les divers procédés chimiques d’échange, qui exploitent un effet isotopique cinétique. En effet, la différence de masse entre les deux isotopes d’hydrogène se traduit par une légère différence des propriétés physicochimique comme la vitesse de diffusion (cf. Uranium) ou de réaction. Une fois que l’isotopomère HDO devient une fraction significative de l’eau, la teneur en eau lourde augmente grâce aux échanges H/D qui ont lieu du fait de l’acidité des protons et deutérons :
La production de l’eau lourde pure par distillation ou électrolyse exige une longue cascade de colonnes de distillation ou de cellules d’électrolyse et consomme énormément d’énergie. Dans le procédé électrolytique, le dihydrogène 1H2 se dégage beaucoup plus rapidement à la cathode que le deutérium, conduisant ainsi à l’augmentation de la concentration de l’électrolyte en D2O.
Il fut mis en œuvre pour la première fois en 1934 par la société Norsk Hydro (maintenant Yara) dans son usine de Vemork, en Norvège, d’une capacité de 12 t/an.
Pour l’Histoire, Frédéric Joliot-Curie obtient l’achat par la France du stock mondial d’eau lourde détenu par la Norvège, stock que Hans von Halban et Lew Kowarski emporteront à Londres en juin 1940, et les Alliés décidèrent de détruire l’usine afin d’empêcher l’Allemagne de développer des armes nucléaires L’usine fut finalement bombardée en 1943 après plusieurs tentatives narrées dans les films La Bataille de l’Eau lourde et les Héros de Télémark.
Le procédé actuellement le plus utilisé est le procédé Girdler, mis au point indépendamment par Karl-Hermann Geib and Jerome S. Spevack au début des années 40. Ce procédé exploite l’échange H/D entre l’eau et le sulfure d’hydrogène (cf. Sulfure d’hydrogène). L’unité de base est constituée de deux colonnes garnies de tamis moléculaires, l’une maintenue à 30 °C (tour dite froide) et l’autre à 130°C (tour dite chaude). Le sulfure d’hydrogène circule en boucle entre la tour froide et la tour chaude. L’eau déminéralisée et dégazée est introduite dans la tour froide où l’échange de deutérium a lieu préférentiellement du sulfure d’hydrogène vers l’eau liquide. L’eau de la tour froide alimente la tour chaude où le transfert de deutérium a lieu de l’eau vers le sulfure d’hydrogène. Une cascade de tours conduit à une eau enrichie en deutérium à 15-20 %. L’eau lourde pure (> 99 %) est ensuite obtenue dans une unité de distillation sous vide.
Les propriétés physiques de l’eau lourde sont peu différentes de celles de l’eau légère, H2O. L’eau lourde est 10.6 % plus dense, une différence que l’on peut visualiser avec un glaçon d’eau lourde qui tombe au fond d’un bécher rempli d’eau. Si cette eau est glacée, le point de fusion plus élevé de la glace « lourde » (3,8 °C) permet de maintenir en l’état ce glaçon…
La différence la plus importante concerne la section efficace de capture des neutrons (σ = 0,00046 barn), pratiquement mille fois inférieure à celle de l’eau légère (σ = 0,33 barn), ce qui explique l’utilisation de l’eau lourde dans certains types de réacteurs nucléaires où elle agit en tant que modérateur pour ralentir des neutrons de sorte qu’ils réagissent avec l’uranium-235 fissile et non avec l’uranium-238 qui capture des neutrons sans fission, mais produit du plutonium-239 (cf. Plutonium).
On comprend ainsi l’importance de l’eau lourde dès 1938, date de la première observation d’une fission nucléaire.
L’eau légère agit également en tant que modérateur mais parce que l’eau légère absorbe plus de neutrons que l’eau lourde, les réacteurs utilisant l’eau légère doivent employer de l’uranium enrichi plutôt que l’uranium normal. Puisqu’ils n’exigent pas l’enrichissement de l’uranium, les réacteurs à eau lourde sont étroitement contrôlés par l’Agence internationale de l’énergie atomique (AIEA) pour éviter la prolifération nucléaire. Rappelons que la plupart des réacteurs modernes emploient l’uranium enrichi et l’eau légère comme modérateur.
En dehors de cette utilisation, l’eau lourde a des emplois beaucoup plus pacifiques qui concernent les chimistes et les biochimistes :
– synthèse de molécules marquées par échange H/D en milieu acide ou basique de certaines liaisons C–H. Par extension, le dideutérium, préparé par électrolyse de l’eau lourde, est employé pour la réduction de liaisons multiples, augmentant ainsi la palette de molécules deutériées, désignées le plus souvent comme « molécules marquées »,
– solvant en spectroscopie de résonance magnétique nucléaire pour l’observation des protons de molécules et biomolécules solubles dans l’eau, du fait d’un moment magnétique du deutérium différent de celui de l’hydrogène. Par extension, l’emploi des solvants deutériés permet l’étude spectroscopique de molécules non hydrosolubles,
– étude de l’effet isotopique : si la substitution au sein d’une molécule d’un atome par un isotope ne modifie que faiblement les propriétés chimiques globales de cette dernière, les vitesses des réactions qui mettent en jeu la molécule marquée sont modifiées. Ce changement, qui reste faible, est appelé effet isotopique.
– Il existe en fait trois effets isotopiques : primaire, secondaire et celui associé au solvant.
– Dans le cas de l’effet isotopique primaire, la liaison qui lie l’isotope à la molécule est rompue. Cette rupture si elle intervient au cours de l’étape cinétiquement déterminante de la réaction conduit à une variation significative de la vitesse de réaction.
– Pour l’effet isotopique secondaire, il ne se produit pas de rupture de la liaison établie avec l’isotope, mais ce dernier est suffisamment proche du centre réactionnel pour que les modifications au niveau des fréquences de vibration des liaisons impliquées par la substitution isotopique puissent influer sur la vitesse de réaction.
– L’effet isotopique de solvant, est observé pour un solvant où un atome est substitué par un isotope plus lourd : c’est le cas des eaux légère et lourde. Cette substitution modifie les propriétés physiques de ce solvant, entraînant ainsi une modification de la vitesse des réactions ayant lieu dans ce solvant.
L’effet isotopique primaire, qui est exprimé par le rapport des vitesses kisotope léger/kisotope lourd, est sans aucun doute le plus important. Il est d’autant plus élevé que le rapport des masses atomiques des deux isotopes est faible. Ainsi, les effets isotopiques primaires les plus importants que l’on puisse observer sont obtenus en substituant, au sein d’une molécule, des atomes d’hydrogène par des atomes de deutérium (rapport 1 à 2) ou encore mieux par des atomes de tritium, 3H (rapport 1 à 3).
Pensée du jour :
«Eau lourde : eau miraculeuse pour les physico-chimistes.»
Sources :
– http://fr.wikipedia.org/wiki/Eau_lourde
– http://en.wikipedia.org/wiki/Heavy_water
– http://fr.wikipedia.org/wiki/Bataille_de_l’eau_lourde
– http://en.wikipedia.org/wiki/Girdler_sulfide_process
Pour en savoir plus :
– Hydrogène
– Uranium
– Sulfure d’hydrogène
– Plutonium

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie