De formule H-C≡N, le cyanure d’hydrogène est un composé produit naturellement par certains végétaux, et peut être trouvé notamment dans les amandes amères, les noyaux de pêche et d’abricot et plus généralement les noyaux des fruits du genre Prunus, dans les racines de manioc, etc. Certains millepattes dégagent du cyanure d’hydrogène comme mécanisme de
défense, à rajouter au catalogue des délices de la nature (cf. Venins et
Poisons). Il est contenu dans les gaz d’échappement des véhicules à combustion interne, dans la fumée de tabac (cf. Nicotine) et dans la fumée de combustion de certaines matières plastiques contenant de l’azote : polyuréthanes (cf. Polyuréthanes), polyacrylonitrile (cf. Butadiène, Styrène). Enfin, il a été identifié par différentes techniques spectroscopiques dans les nuages interstellaires.
C’est en 1752 que le chimiste français Pierre Macquer montra que le bleu de Prusse connu depuis 1704 pouvait être décomposé en oxydes de fer et un composé volatil, et reconstitué à partir de ces composés ({vide infra). C’est Carl Wilhelm Scheele (encore !) qui l’isola à l’état pur en 1783 en faisant réagir l’acide sulfurique sur un dérivé de ce colorant :
2 K4Fe(CN)6] + 3 H2SO4 ———> K2[Fe(CN)6] + 3 K2SO4 + 6 HCN
Il l’appela Blausäure pour sa nature acide en solution aqueuse. En 1787, Claude Louis Berthollet montra que l’acide prussique ne contenait pas d’oxygène, mettant à mal la théorie postulant que tout acide doit contenir de l’oxygène. Enfin, c’est en 1815 que Joseph Louis Gay-Lussac (cf. J.-L. Gay-Lussac) établit sa formule et donna au radical CN le nom de cyano, du grec κψανοσ signifiant bleu.
Le cyanure d’hydrogène se présente, à l’état pur, sous la forme d’un liquide incolore (Eb = 26 °C) très volatil, ou d’un gaz incolore exhalant une odeur caractéristique d’amande amère. Il est faiblement acide (pKa 9,2) et produit des ions cyanure CN- en solution aqueuse.
Sa préparation repose toujours sur le principe développé en 1894 par Hamilton Castner qui employait un mélange chauffé de charbon, ammoniac (cf. Ammoniac) et sodium (cf. Sodium) produisant du cyanure de sodium. Actuellement, en plus de sa récupération lors de la synthèse de l’acrylonitrile, le cyanure d’hydrogène est obtenu selon trois procédés :
– procédé Adrussow, développé à l’IG Farben, consistant à faire réagir à 1 200 °C méthane et ammoniac en présence du dioxygène de l’air et au contact d’une toile de platine rhodié :
2 CH4 + 2 NH3 + 3 O2 ———> 2 HCN + 6 H2O
– procédé Degussa, dans lequel l’énergie nécessaire à la réaction est fournie par les parois du réacteur, chauffées à 1 100 °C :
CH4 + NH3 ———> HCN + 3 H2
– procédé Shawinigan où le méthane est remplacé par un hydrocarbure léger, par exemple le propylène (cf. Propylène)
C3H8 + 3 NH3 ———> 3 HCN + 7 H2
Au laboratoire, l’acide cyanhydrique est obtenu par réaction d’un acide sur un cyanure alcalin.
La production mondiale est estimée à environ 2 Mt. Toutefois, compte tenu de sa toxicité, c’est un produit essentiellement captif qui est immédiatement employé sur les sites industriels pour la production en aval d’intermédiaires de synthèse et de monomères. Ainsi, à Chalampé (Haut-Rhin), le cyanure d’hydrogène est utilisé à raison de 70 kt/an en réaction d’hydrocyanation du butadiène catalysée par des complexes du nickel (cf. Butadiène), conduisant à l’adiponitrile, un des précurseurs du nylon-6,6 (cf. Nylon).
L’acide cyanhydrique est le précurseur des cyanures de sodium et de potassium qui trouvent beaucoup d’applications dans l’extraction et dans la concentration des minerais, notamment d’or et d’argent, ainsi que dans les procédés électrolytiques. L’ion cyanure est un excellent nucléophile, réagissant notamment avec :
– les halogénures d’alkyle, RX et d’aryle, ArX, pour conduire aux nitriles RCN et ArCN, précurseurs d’amides et d’acides carboxyliques, voire intermédiaires dans le procédé d’homologation des acides carboxyliques,
– les aldéhydes et les cétones pour conduire à des cyanhydrines, intermédiaires de synthèse du méthacrylate de méthyle (par réaction avec l’acétone), précurseur du plexiglas ou de la méthionine (par réaction avec l’acroléine), acide aminé employé dans l’industrie agro-alimentaire.
C’est aussi un excellent ligand en chimie de coordination, lié notamment à sa capacité de rétrodonation dans la formation d’une liaison avec un ion de métal de transition (cf. Éthylène, Monoxyde de carbone).
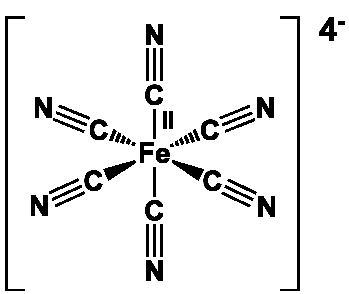
On peut citer les octocyanures, [M(CN)8]4- (M= Mo, W), qui ont une structure dodécaédrique, les hexacyanures, [M(CN)6]3- (M = Ti, V, Cr, Mn, Fe, Co), qui ont une structure octaédrique, les tétracyanures, [M(CN)4]2- (M = Ni, Pd, Pt), qui ont une configuration carrée plane et les dicyanures, [M(CN)2]– (M = Cu, Ag, Au), qui ont une structure linéaire. Le bleu de Prusse est un polymère de composition Fe7(CN)18(H2O)x, où x varie de 14 à 18 : c’est un ferrocyanure ferrique présentant des enchainements Fe(II)-C-N-Fe(III) responsables de la coloration bleue intense.
De ce fait, les cyanures et le cyanure d’hydrogène sont des poisons très puissants, car ils inhibent les processus de transport de l’oxygène au niveau de l’hémoglobine (cf. Hémoglobine) et d’oxydation cellulaire au niveau de la cytochrome c oxydase (cf. Cytochrome P450), deux métalloenzynes.
La présence d’acide cyanhydrique dans les fruits à noyaux est due à des cyanhydrines comme le mandelonitrile et l’amygdaline qui relarguent lentement de l’acide cyanhydrique et du benzaldéhyde, principal arôme de l’amande amère (cf. Arômes) : 100 g de pépins de pomme fournissent 10 mg d’acide cyanhydrique et l’ingestion de 50 amandes amères fraiches peut causer la mort d’un homme….
L’intoxication aigüe peut survenir par ingestion, par inhalation, ou par contact avec la peau. Une concentration de 300 ppm dans l’air tue un homme en quelques minutes Rappelons que le cyanure d’hydrogène, sous la forme de Zyklon B (cyclone B en français…), a notamment été employé par le régime Nazi dans les camps d’extermination comme outil de l’Holocauste.
Quoique sujet à controverse, le cyanure d’hydrogène a été proposé comme précurseur des aminoacides et des acides nucléiques et aurait ainsi joué un rôle dans l’apparition de la vie. La voie préférentielle pour synthétiser l’acide cyanhydrique à partir de l’azote semble être les éclairs qui libèrent une énergie, suffisante pour dissocier le diazote (cf. Ammoniac). Les atomes d’azote réagissent avec le méthane pour donner de l’acide cyanhydrique et du dihydrogène. La suite est beaucoup plus complexe d’où la…
Pensée du jour :
«L’acide cyanhydrique, dans le droit fil du questionnement de Guy Ourisson : Chimie de la Vie, Chimie de la Mort ?»
Sources :
– http://fr.wikipedia.org/wiki/Cyanure_d’hydrogène
– http://en.wikipedia.org/wiki/Hydrogen_cyanide
– www.inrs.fr/accueil/produits/bdd/doc/fichetox.html?refINRS=FT 4
– http://fr.wikipedia.org/wiki/Cyanure
– http://en.wikipedia.org/wiki/Cyanide
– http://en.wikipedia.org/wiki/Prussian_blue
Pour en savoir plus :
– Venins et Poisons
– Nicotine
– Polyuréthanes
– Butadiène
– Styrène
– J. L. Gay-Lussac
– Ammoniac
– Sodium
– Propylène
– Nylon
– Argent
– Éthylène
– Monoxyde de carbone
– Hémoglobine
– Cytochrome P450
– Arômes

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie